题目内容
【题目】常温下,向10 mL 0.2molL-1 的MOH中逐滴加入0.2 molL-1的CH3COOH溶液,溶液的导电能力如图1所示,溶液的pH 变化如图2所示(已知:常温时,NH3H2O和CH3COOH的电离常数均为1.8×10-5), 下列说法正确的是
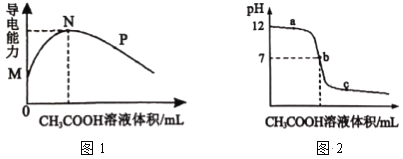
A.图l中N点时,加入CH3COOH溶液的体积为l 0 mL
B.MOH是一种弱碱,相同条件下其碱性弱于 NH3H2O 的碱性
C.图2中b点时,加入CH3COOH溶液的体积为l 0 mL
D.若c点对应醋酸的体积是15 mL,则此时溶液中:c(CH3COOH) + c(CH3COO-) < 0.1 molL-1
【答案】A
【解析】
根据图2可知,0.2molL-1 的MOH的pH=12,说明MOH为弱碱,则MOH的电离平衡常数=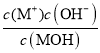 =
=![]() =5.2×10-4;向10 mL 0.2molL-1 的MOH中逐滴加入0.2 molL-1的CH3COOH溶液,随着醋酸的加入,溶液的导电能力逐渐增强,是因为反应生成了强电解质CH3COOM,当二者恰好完全反应时,溶液中CH3COOM浓度最大,溶液的导电能力最强,继续滴加醋酸溶液,溶液的体积增大,溶液的导电能力又逐渐减小,结合滴定曲线分析解答。
=5.2×10-4;向10 mL 0.2molL-1 的MOH中逐滴加入0.2 molL-1的CH3COOH溶液,随着醋酸的加入,溶液的导电能力逐渐增强,是因为反应生成了强电解质CH3COOM,当二者恰好完全反应时,溶液中CH3COOM浓度最大,溶液的导电能力最强,继续滴加醋酸溶液,溶液的体积增大,溶液的导电能力又逐渐减小,结合滴定曲线分析解答。
A.MOH为弱碱,向10 mL 0.2molL-1 的MOH中逐滴加入0.2 molL-1的CH3COOH溶液,随着醋酸的加入,溶液的导电能力逐渐增强,是因为反应生成了强电解质CH3COOM,当二者恰好完全反应时,溶液中CH3COOM浓度最大,溶液的导电能力最强,因此图l中N点时,加入CH3COOH溶液的体积为l 0 mL,故A正确;
B.根据上述计算,MOH的电离平衡常数=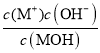 =
=![]() =5.2×10-4>1.8×10-5,即相同条件下其碱性比 NH3H2O 的碱性强,故B错误;
=5.2×10-4>1.8×10-5,即相同条件下其碱性比 NH3H2O 的碱性强,故B错误;
C.常温时,NH3H2O和CH3COOH的电离常数均为1.8×10-5,说明醋酸铵溶液显中性;MOH的碱性比 NH3H2O 的碱性强,与醋酸恰好中和时,溶液显碱性,而b点pH=7,因此b点不是滴定终点,而且b点加入CH3COOH溶液的体积大于l 0 mL,故C错误;
D.若c点对应醋酸的体积是15 mL,此时溶液中含有醋酸和CH3COOM,根据物料守恒,c(CH3COOH) + c(CH3COO-)= ![]() >0.1 molL-1,故D错误。
>0.1 molL-1,故D错误。
故选A。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案