题目内容
【题目】某同学欲配制100mL0.20mol·L-1的KCl溶液,实验操作如下:
A. 用托盘天平准确称取1.49gKCl固体,并放入烧杯中;
B. 加入约30mL蒸馏水,用玻璃棒搅拌使其溶解,并恢复至室温;
C .将KCl溶液由烧杯小心倒入100mL容量瓶中;
D .然后往容量瓶中加蒸馏水,直到液面接近标线1-2cm处,轻轻摇动容量瓶并静置片刻后,改用胶头滴管滴加蒸馏水;
E.使溶液凹面最低点恰好与刻度相切,把容量瓶盖好,上下翻转摇匀后装瓶。
(1)该学生操作中错误的是____________(填写字母序号)。
(2)下面哪些操作会导致所配的100mL0.20mol/L的KCl溶液浓度降低___________。
A 容量瓶用蒸馏水洗涤三次直到洗净 B 称量KCl固体时将砝码放在左盘
C 未洗涤转移KCl溶液的烧杯 D 转移KCl溶液时有KCl溶液溅出
E 定容时仰视刻度线
(3)若用0.2mol·L-1的KCl溶液配制0.05mol·L-1的KCl溶液200.0mL,需要0.20mol·L-1的KCl溶液____________mL。
(4)若在标准状况下,将V LHCl气体溶于1L水中,所得溶液密度为d g/mL,则此溶液的物质的量浓度为________mol/L。(填字母)
A ![]() B
B ![]() C
C ![]()
![]() D
D ![]()
【答案】ACD BCDE 50.0 A
【解析】
用固体溶质配制一定物质的量浓度的溶液需要经过计算、称量、溶解、转移、洗涤、定容、摇匀、转移等步骤。
(1)A.托盘天平称量物体时只能准确到0.1g,所以无法用托盘天平准确称取1.49gKCl故体,故A错误;
B.加入约30mL蒸馏水,用玻璃棒搅拌使其溶解,由于容量瓶不能受热,故要将溶液恢复至室温,故B正确;
C.将KCl溶液转移到容量瓶中时,需要用玻璃棒引流,不能直接倒入,故C错误;
D.将KCl溶液转移到容量瓶中后要用蒸馏水洗涤所用的烧杯和玻璃棒2~3次,把洗涤液也转移到容量瓶中,然后再加蒸馏水定容,故D错误;
E.定容时,开始时直接往容量瓶中加蒸馏水,直到液面接近标线1-2cm处,轻轻摇动容量瓶并静置片刻后,改用胶头滴管滴加蒸馏水使溶液凹面最低点恰好与刻度相切,把容量瓶盖好,上下翻转摇匀后装瓶,故E正确;
综上所述选ACD。
(2)A.配制溶液前,容量瓶需要洗涤干净,即使里面有一些残留的蒸馏水,对溶质和最终得到的溶液体积也没有影响,故A不选;
B.称量KCl固体时将砝码放在左盘,称量过程中需要使用游码,则会使溶质的物质的量变少,导致所配溶液浓度降低,故B选;
C.未洗涤转移KCl的烧杯,会使溶质没有全部转移到容量瓶中,导致所配溶液浓度降低,故C选;
D.转移KCl溶液时有KCl溶液溅出,溶质有损失,会导致所配溶液浓度降低,故D选;
E.定容时仰视刻度线,会导致加入的蒸馏水超过刻度线,溶液体积变大,溶液浓度降低,故E选;
综上所述选BCDE;
(3)用比较浓的溶液配制稀溶液,需要向浓溶液里加水稀释,根据稀释前后溶质的物质的量不变可得0.2mol·L-1V=0.05mol·L-1×0.2L,可求得V=0.05L,即50.0mL;
(4)标准状况下,VLHCl的物质的量为![]() ,质量为
,质量为![]() ,1L水为1000g,所以盐酸的质量为
,1L水为1000g,所以盐酸的质量为![]() ,根据盐酸的密度可求出盐酸的体积:
,根据盐酸的密度可求出盐酸的体积: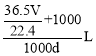 ,所以盐酸中HCl的物质的量浓度为
,所以盐酸中HCl的物质的量浓度为![]() ,故答案为A。
,故答案为A。

 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案