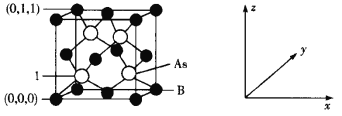
题目内容
【题目】当溶液中离子浓度小于1.0×10-5 molL-1 时,可视为该离子已完全除去,通过调节溶液pH的方法可以除去溶液中的某些杂质离子。常温下,某0.1 molL-1 的NiSO4溶液中含有杂质Al3+和 Fe3+,欲将这两种杂质完全除去, 需调节溶液pH 的范围可以是(不考虑溶液体积变化,已知:常温时,氢氧化镍Ksp = 1×10-16、 氢氧化铁Ksp =1×10-38、氢氧化铝Ksp = 1×10 -33)
A.2~3B.3~4
C.5 ~6D.6~8
【答案】C
【解析】
根据Ksp计算使得Al3+和Fe3+完全沉淀时溶液的pH值和Ni 2+开始沉淀时溶液的pH值,据此分析判断。
Ksp[Al(OH)3]=1×10-33=c(Al3+)×c3(OH-),c(Al3+)=1×10-5molL-1,解得:c(OH-)=![]() ×10-9molL-1,c(H+)=
×10-9molL-1,c(H+)=![]() ×10-5molL-1,pH略小于5时Al3+完全变成沉淀;同理,Ksp[Fe(OH)3]=1×10-38=c(Fe3+)×c3(OH-),c(Fe3+)=1×10-5molL-1,解得:c(OH-)=1 ×10-11molL-1,c(H+)=1×10-3molL-1,pH=3时Fe3+完全变成沉淀;Ksp[Ni(OH)2]=1×10-16=c(Ni 2+)×c2(OH-),c(Ni 2+)=0.1molL-1,解得:c(OH-)=
×10-5molL-1,pH略小于5时Al3+完全变成沉淀;同理,Ksp[Fe(OH)3]=1×10-38=c(Fe3+)×c3(OH-),c(Fe3+)=1×10-5molL-1,解得:c(OH-)=1 ×10-11molL-1,c(H+)=1×10-3molL-1,pH=3时Fe3+完全变成沉淀;Ksp[Ni(OH)2]=1×10-16=c(Ni 2+)×c2(OH-),c(Ni 2+)=0.1molL-1,解得:c(OH-)=![]() ×10-7molL-1,c(H+)=
×10-7molL-1,c(H+)=![]() ×10-7molL-1,pH略小于7时Ni 2+开始变成沉淀;因此需调节溶液pH 的范围为5 ~6。
×10-7molL-1,pH略小于7时Ni 2+开始变成沉淀;因此需调节溶液pH 的范围为5 ~6。
故选C。

 阅读快车系列答案
阅读快车系列答案【题目】亚硝酰氯(NOCl,熔点:-64.5 ℃,沸点:-5.5 ℃)是一种黄色气体,遇水易水解。可用于合成清洁剂、触媒剂及中间体等。实验室可由氯气与一氧化氮在常温常压下合成。
(1)甲组的同学拟制备原料气NO和Cl2,制备装置如下图所示:

为制备纯净干燥的气体,下表中缺少的药品是:
装置Ⅰ | 装置Ⅱ | ||
烧瓶中 | 分液漏斗中 | ||
制备纯净Cl2 | MnO2 | ①___ | ②___ |
制备纯净NO | Cu | ③___ | ④___ |
(2)乙组同学利用甲组制得的NO和Cl2制备NOCl,装置如图所示:

①装置连接顺序为a→________(按气流自左向右方向,用小写字母表示)。
②装置Ⅳ、Ⅴ除可进一步干燥NO、Cl2外,另一个作用是____________。
③装置Ⅶ的作用是____________。
④装置Ⅷ中吸收尾气时,NOCl发生反应的化学方程式为________________。
(3)丙组同学查阅资料,查得王水是浓硝酸与浓盐酸的混酸,一定条件下该混酸可生成亚硝酰氯和氯气, 该反应的化学方程式为__________________。