题目内容
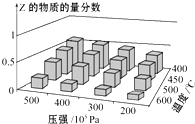
【题目】中和滴定是实验室定量测定未知酸或碱浓度的重要方法。25℃时,向 20.00 mL NaOH溶液中逐滴滴入某浓度的CH3COOH溶液以测定该醋酸溶液的浓度。滴定过程中,溶液的pH与滴入CH3COOH 溶液的体积关系如图所示, 回答下列问题:
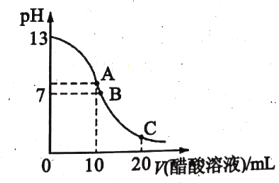
(1)滴定时,使用到的主要玻璃仪器有__________。
(2)选择的指示剂是_________,如何判断滴定达到终点 _____________。
(3)若当滴定达到终点时,测得消耗 CH3COOH 溶液的体积为 10.00 mL. 则所测醋酸溶液的浓度为 _________molL-1。
(4)图中B 点所示溶液中c(Na +)______c(CH3COO-)(填“>”“<”或“=”)。
(5)图中 C 点对应的pH=4.7,该点所示溶液中c(CH3COO-)+ c(OH-)-c(Na+)=________ molL-1(已知:lg2=0.3)。
【答案】酸式滴定管、锥形瓶、碱式滴定管 酚酞 滴入最后一滴醋酸溶液振荡,溶液由红色变成浅红色,且半分钟内不恢复红色 0.20 = 2.0×105
【解析】
中和滴定使用到的主要玻璃仪器有酸式滴定管、碱式滴定管、锥形瓶;根据滴定终点的酸碱性选择指示剂;根据滴定曲线的起点确定氢氧化钠标准溶液的浓度,并根据其消耗量计算醋酸的物质的量浓度;根据电荷守恒确定相关离子浓度之间的关系。
(1)滴定时,使用到的主要玻璃仪器有酸式滴定管、锥形瓶、碱式滴定管。
(2)滴定终点得到的醋酸钠溶液显碱性,酚酞的变色范围是8.2~10.0,故可选择酚酞作指示剂,滴定达到终点的判断方法是:滴入最后一滴醋酸溶液振荡,溶液由红色变成浅红色,且半分钟内不恢复红色。
(3)由滴定曲线的起点可知,所用标准碱液的pH=13、体积为20.00 mL,则c(NaOH)=0.10mol/L,滴定达到终点时,测得消耗CH3COOH溶液的体积为 10.00 mL,则所测醋酸溶液的浓度为![]() 0.20molL-1。
0.20molL-1。
(4)图中B 点所示溶液中pH=7,溶液显中性,c(OH-)=c(H+),根据电荷守恒c(Na +)+ c(H+)= c(OH-) +c(CH3COO-)可知,c(Na +)=c(CH3COO-)。
(5)图中 C 点对应的pH=4.7,则c(H+)=10-4.7mol/L=2.0×105molL-1,根据电荷守恒c(Na +)+ c(H+)= c(OH-) +c(CH3COO-)可知,该点所示溶液中c(CH3COO-)+c(OH-)-c(Na+)= c(H+)=2.0×105molL-1。