题目内容
【题目】从报废后的锂电池(主要成分为LiCoO2,此外含铁、铝、铜、锰、镍等)中回收有关物质,回收工艺流程如下:
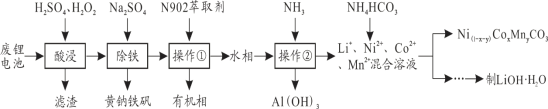
(1)操作②的名称为_______________,操作①的目的是___________________________。
(2)写出酸浸过程中LiCoO2发生氧化还原反应的化学方程式_______________________。
(3)室温下,各物质的Ksp如下表所示:(已知:lg2=0.3、1g6=0.8)
物质 | Al(OH)3 | Mn(OH)2 | Co(OH)2 | Ni(OH)2 |
Ksp | 1×10-35 | 2×10-13 | 6×10-15 | 4×10-15 |
若水相中各金属离子浓度均为0.1mol/L,且离子浓度小于1.0×10-5mol/L,即认为该离子已完全除去,操作②需调节溶液pH的取值范围为_________。(保留1位小数)
(4)某锂离子电池正极材料含有LiNi1/3Co1/3Mn1/3O2,其中Ni、Co的化合价分别为+2、+3,则Mn的化合价为_______。该材料可通过回收的Ni(1-x-y)CoxMnyCO3与LiOH·H2O烧结得到,反应中不能隔绝空气,其原因是_______________________________________________________。
【答案】过滤 除铜 2LiCoO2+H2O2+3H2SO4=Li2SO4+2CoSO4+4H2O+O2↑ 4.0≤pH<7.3(写4.0~7.3也可) +4 需要空气中的O2把其中+2价的Co和+2价的Mn氧化为更高的价态
【解析】
由流程图可知,废锂电池(主要成分为LiCoO2,此外含铁、铝、铜、锰、镍等),拆解后酸浸,加入过氧化氢还原+3价钴,过滤除去不溶性杂质,滤液加Na2SO4除铁(形成黄钠铁矾),加萃取剂萃取除铜,再通氨气,调节溶液pH沉淀铝离子过滤得到固体氢氧化铝;此时滤液中含有Li+、Ni2+、Co2+、Mn2+,再加NH4HCO3制LiOH![]() H2O,并回收Co。
H2O,并回收Co。
(1)根据上述工艺流程图得出,操作②的名称为过滤,操作①为萃取,其目的是除铜,
因此,本题正确答案是:过滤;除铜;
(2)LiCoO2和H2O2在酸性条件下发生氧化还原反应生成硫酸锂、硫酸钴、水和氧气,反应的化学方程式为:2LiCoO2+H2O2+3H2SO4=Li2SO4+2CoSO4+4H2O+O2↑,
因此,本题正确答案是:2LiCoO2+H2O2+3H2SO4=Li2SO4+2CoSO4+4H2O+O2↑;
(3)由上述工艺流程图可知,操作②需调节溶液pH的目的是使Al(OH)3沉淀完全,而Ni2+、Co2+、Mn2+不沉淀,
若使Al(OH)3沉淀完全,根据Ksp[Al(OH)3]=c(Al3+)c3(OH-),则c(OH-)=![]() =10-10mol/L,所以pH=-lg10-4=4.0,
=10-10mol/L,所以pH=-lg10-4=4.0,
若使Ni2+、Co2+、Mn2+不沉淀,由于Ni(OH)2溶度积最小,若Ni(OH)2不沉淀,则Co2+、Mn2+也不沉淀,根据Ksp[Ni(OH)2]=c(Ni2+)c2(OH-),则c(OH-)=![]() =2×10-7mol/L,
=2×10-7mol/L,
c(H+)=![]() =5×10-8,pH=-lg5×10-8=8-lg5=7.3,
=5×10-8,pH=-lg5×10-8=8-lg5=7.3,
调节溶液pH的取值范围为4.0≤pH<7.3,
因此,本题正确答案是:4.0≤pH<7.3;
(4)根据化合价代数和为0,LiNi1/3Co1/3Mn1/3O2中Ni、Co的化合价分别为+2、+3,设Mn的化合价为x。则1+(+2)![]() +(+3)
+(+3)![]() +x
+x![]() +(-2)×2=0,计算得x=+4,
+(-2)×2=0,计算得x=+4,
由Ni(1-x-y)CoxMnyCO3可知Co和Mn的化合价较低,需要O2将其氧化到较高价态,故通过回收的Ni(1-x-y)CoxMnyCO3与LiOH·H2O烧结得到LiNi1/3Co1/3Mn1/3O2,反应中不能隔绝空气,
因此,本题正确答案是:+4;需要空气中的O2把其中+2价的Co和+2价的Mn氧化为更高的价态。

【题目】恒温恒容下,向2L密闭容器中加入MgSO4和CO(g),发生反应:
MgSO4(s)+CO(g)![]() MgO(s)+CO2(g)+SO2(g),反应过程中测定的部分数据见下表:
MgO(s)+CO2(g)+SO2(g),反应过程中测定的部分数据见下表:
反应时间/min | n(MgSO4)/mol | n(CO)/mol | n(CO2)/mol |
0 | 2.00 | 2.00 | 0 |
2 | 0.80 | ||
4 | 1.20 |
下列说法正确的是
A. 反应在0~2min内的平均速率为v(SO2)=0.6mol·L-1·min-1
B. 反应在2~4min内容器内气体的密度没有变化
C. 若升高温度,反应的平衡常数变为1.00,则正反应为放热反应
D. 保持其他条件不变,起始时向容器中充入1.00molMgSO4和1.00molCO,到达平衡时n(CO2)>0.60mol

