题目内容
【题目】一定条件下,将3molA和1molB两种气体混合于固定容积为2L的密闭容器中,发生如下反应:3A(g)+B(g)![]() xC(g)+ 2D(s)。2min末该反应达到平衡,生成0.8molD,并测得C的浓度为0.2mol/L。下列判断正确的是
xC(g)+ 2D(s)。2min末该反应达到平衡,生成0.8molD,并测得C的浓度为0.2mol/L。下列判断正确的是
A. 从开始到平衡A的平均反应速率为0.3mol/(L![]() s)
s)
B. 从开始到平衡B的转化率为60%
C. 此反应的化学平衡常数表达式:![]()
D. 若混合气体的密度或压强不再改变时,该反应一定达到平衡状态
【答案】D
【解析】
2min末该反应达到平衡,生成0.8molD,并测得C的浓度为0.2mol/L,生成C为0.2mol/L×2L=0.4mol,则![]() =
=![]() ,解得x=1,则
,解得x=1,则
3A(g)+B(g)C(g)+2D(s)
开始 3 1 0 0
转化 1.2 0.4 0.4 0.8
平衡 1.8 0.6 0.4 0.8
A.从开始到平衡A的平均反应速率为![]() =0.3mol/(L·min),故A错误;B.从开始到平衡B的转化率为
=0.3mol/(L·min),故A错误;B.从开始到平衡B的转化率为![]() ×100%=40%,故B错误;C.D为固体,此反应的化学平衡常数表达式K=
×100%=40%,故B错误;C.D为固体,此反应的化学平衡常数表达式K=![]() ,故C错误;D.D为固体,混合气体的质量为变量,由ρ=
,故C错误;D.D为固体,混合气体的质量为变量,由ρ=![]() 可知,密度为变量,则若混合气体的密度不再改变时,该反应一定达到平衡状态,反应恰好气体的物质的量发生变化,因此容器内气体的压强为变量,压强不变说明反应达到平衡状态,故D正确;故选D。
可知,密度为变量,则若混合气体的密度不再改变时,该反应一定达到平衡状态,反应恰好气体的物质的量发生变化,因此容器内气体的压强为变量,压强不变说明反应达到平衡状态,故D正确;故选D。

【题目】从报废后的锂电池(主要成分为LiCoO2,此外含铁、铝、铜、锰、镍等)中回收有关物质,回收工艺流程如下:
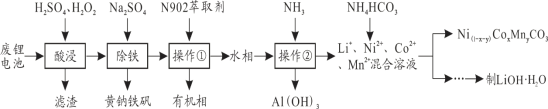
(1)操作②的名称为_______________,操作①的目的是___________________________。
(2)写出酸浸过程中LiCoO2发生氧化还原反应的化学方程式_______________________。
(3)室温下,各物质的Ksp如下表所示:(已知:lg2=0.3、1g6=0.8)
物质 | Al(OH)3 | Mn(OH)2 | Co(OH)2 | Ni(OH)2 |
Ksp | 1×10-35 | 2×10-13 | 6×10-15 | 4×10-15 |
若水相中各金属离子浓度均为0.1mol/L,且离子浓度小于1.0×10-5mol/L,即认为该离子已完全除去,操作②需调节溶液pH的取值范围为_________。(保留1位小数)
(4)某锂离子电池正极材料含有LiNi1/3Co1/3Mn1/3O2,其中Ni、Co的化合价分别为+2、+3,则Mn的化合价为_______。该材料可通过回收的Ni(1-x-y)CoxMnyCO3与LiOH·H2O烧结得到,反应中不能隔绝空气,其原因是_______________________________________________________。