题目内容
14.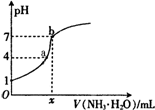 向20.00mL稀H2SO4中逐滴加入0.10mol/L的氨水,测得溶液的pH随加入氨水的体积变化如图所示.下列判断正确的是( )
向20.00mL稀H2SO4中逐滴加入0.10mol/L的氨水,测得溶液的pH随加入氨水的体积变化如图所示.下列判断正确的是( )| A. | x=20 | B. | 稀H2SO4的浓度为0.10mol/L | ||
| C. | b点有:2c(NH4+)=c(SO42-)>c(H+)=c(OH-) | D. | a点有:c(NH4+)<2c(SO42-) |
分析 A.硫酸和氨水反应,恰好完全反应时,得到的硫酸铵溶液显示酸性,据此确定x的值;
B.开始滴加时,根据硫酸的pH可以计算稀H2SO4的浓度;
C.b点时溶液为中性,则c(H+)=c(OH-),根据电荷守恒可知c(NH4+)=2c(SO42-);
D.根据a点溶液显示酸性,则c(H+)>c(OH-),根据电荷守恒可知c(NH4+)<2c(SO42-).
解答 解:A.硫酸和氨水反应,恰好完全反应时,得到的硫酸铵溶液显示酸性,当达到中性时,氨水应该稍过量,则x大于20,故A错误;
B.开始滴加时,硫酸的pH是1,即氢离子浓度是0.1mol/L,所以可以计算稀H2SO4的浓度是0.05mol/L,故B错误;
C.b点时pH=7,溶液为中性,则:c(H+)=c(OH-),根据电荷守恒可知c(NH4+)=2c(SO42-),正确的离子浓度大小为:c(NH4+)=2c(SO42-)>c(H+)=c(OH-),故C错误;
D.a点溶液的pH=4,溶液显示酸性,则:c(H+)>c(OH-),根据电荷守恒c(NH4+)+c(H+)=2c(SO42-)+c(OH-)可知c(NH4+)<2c(SO42-),故D正确;
故选D.
点评 本题考查酸碱混合的计算和判断、离子浓度大小比较,题目难度中等,明确图象中a、b点溶液酸碱性及溶质组成为解答关键,注意掌握电荷守恒、物料守恒及盐的水解原理在判断离子浓度大小中的应用方法.

练习册系列答案
相关题目
4.元素周期表是元素周期律的具体表现形式.下列说法正确的是( )
| A. | 第二周期元素的最高正价从左向右依次从+1递增到+7价 | |
| B. | 同一周期从左到右,元素的金属性逐渐增强、非金属性逐渐减弱 | |
| C. | 第IA元素全部是金属元素 | |
| D. | 可在金属与非金属分界线附近寻找半导体材料 |
2.下列说法正确的是( )
| A. | 将FeCl3饱和溶液煮沸可得到带正电荷的Fe(OH)3胶体 | |
| B. | 光导纤维具有很强的导电能力,所以大量用于制造通信光缆 | |
| C. | 硅酸钠溶液可以用作黏合剂,不能用作防火材料 | |
| D. | CaO和HCl的水溶液均能导电,且它们都属于电解质 |
19.下列叙述正确的是( )
| A. | 直径介于1nm~100nm之间的微粒称为胶体 | |
| B. | 电泳现象可证明胶体属于电解质溶液 | |
| C. | 胶体粒子很小,可以透过半透膜 | |
| D. | 利用丁达尔效应可以区别溶液与胶体 |
6.下列关于分子或晶体中心原子的杂化类型的说法正确的是( )
| A. | CH3CH3中的两个碳原子与BF3中的硼原子均采取sp2杂化 | |
| B. | 晶体硅和石英晶体中的硅原子均采取sp3杂化 | |
| C. | BeCl2中的铍原子和H2O中的氧原子均采取sp杂化 | |
| D. | CO2中的碳原子与CH2=CH2中的两个碳原子均采取sp杂化 |
3.化学与人体健康、环境、生产、生活密切相关,下列说法不正确的是( )
| A. | 高纯度的二氧化硅广泛用于制作光导纤维,光导纤维遇强碱会“断路” | |
| B. | 用K2FeO4代替Cl2处理饮用水,既有杀菌消毒作用,也可以起净水作用 | |
| C. | 绿色化学的核心是应用化学原理对环境污染进行治理 | |
| D. | 我国居民普遍存在缺铁性贫血,可在酱油中添加亚铁盐予以改善并同时补充服用维生素C |
4.1mol H2表示的含义是( )
| A. | 1 mol 氢 | B. | 1 mol 氢气 | C. | 1 mol 氢分子 | D. | 1 mol 氢原子 |
 钛和钛的合金已被广泛用于制造电讯器材、人造骨骼、化工设备、飞机等航天航空材料,被誉为“未来世界的金属”.试回答下列问题:
钛和钛的合金已被广泛用于制造电讯器材、人造骨骼、化工设备、飞机等航天航空材料,被誉为“未来世界的金属”.试回答下列问题: