题目内容
5.下列叙述正确的个数有( )①离子键只存在于离子化合物中,共价键只存在于共价化合物和离子化合物中
②元素周期表中核素的种类大于元素的种类
③对于任何化学反应来说,反应速率越快,反应现象就越明显
④用浓硫酸与蛋白质的颜色反应鉴别部分蛋白质
⑤乙烯和聚乙烯都能使酸性高锰酸钾溶液褪色
⑥化学反应中的能量变化主要是由化学键变化引起的
⑦燃料电池的能量转化率可达100%
⑧所有烷烃之间一定互为同系物.
| A. | 2 | B. | 4 | C. | 6 | D. | 8 |
分析 ①离子键只存在于离子化合物中,共价键还存在多原子的单质中;
②元素周期表中核素的种类大于元素的种类,部分元素有多种核素;
③反应速率与反应现象没有必然的关系,反应速率表示的是化学反应相对快慢;
④用浓硝酸与蛋白质的颜色反应鉴别部分蛋白质;
⑤聚乙烯不含碳碳不饱和键;
⑥化学反应的实质是旧化学键断裂,新化学键的形成过程;
⑦燃料电池的能量转化率不能达到100%;
⑧结构相似,在分子组成上相差一个或n个-CH2原子团的有机物是同系物.
解答 解:①离子键只存在于离子化合物中,共价键还存在多原子的单质中,如氮气等,故错误;
②部分元素有多种核素,所以元素周期表中核素的种类大于元素的种类,如H元素有氕氘氚,故错误;
③由于反应速率与反应现象没有必然的关系,反应速率是表示的化学反应相对快慢的,故错误;
④用浓硝酸与蛋白质的颜色反应鉴别部分蛋白质,不是浓硫酸,故错误;
⑤聚乙烯不含碳碳不饱和键,所以不能使高锰酸钾溶液褪色,故错误;
⑥化学反应的实质是旧化学键断裂,新化学键的形成过程,一定伴随能量变化,则化学反应中的能量变化主要是由化学键变化引起的,故正确;
⑦燃料电池中化学能还部分转化为热能等,所以燃料电池的能量转化率不能达到100%,故错误;
⑧结构相似,在分子组成上相差一个或n个-CH2原子团的有机物是同系物,所以烷烃的同系物,故正确;
故选A.
点评 本题考查较综合,涉及基本概念、能量变化、化学反应实质、化学键等知识点,侧重考查基本概念和基本理论,注意采用举例法分析解答,题目难度不大.

练习册系列答案
相关题目
15.下列有关说法正确的是( )
| A. | NaCl溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度不相同 | |
| B. | 由于Ksp(BaSO4)<Ksp(BaCO3),因此不可能使BaSO4沉淀转化为BaCO3沉淀 | |
| C. | 常温下,将pH=4的醋酸溶液稀释后,溶液中所有离子的浓度均降低 | |
| D. | 含1mol[Co(NH3)5Cl]Cl2的溶液与足量的AgNO3溶液混合,能生成2mol的AgCl沉淀 |
16.在恒容密闭容器中,通入1molH2和1molI2(g),发生反应H2(g)+I2(g)?2HI(g),在其他条件不变的情况下,改变下列条件反应速率会降低的是( )
| A. | 升高温度 | B. | 分离出HI | C. | 充入H2 | D. | 充入He |
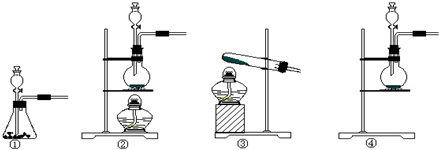
13.下列实验设计或操作正确的是( )
| A. | 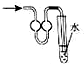 少量氨气的尾气吸收装置 | B. | 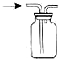 排空气法收集NO气体 | ||
| C. | 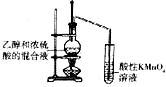 验证乙烯的生成 | D. | 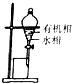 有机相从分液漏斗下口放出 |
20.实验室用溴和苯反应制取溴苯.得到粗溴苯后,要用如下操作精制:①蒸馏;②水洗;③用干燥剂干燥;④10%NaOH溶液洗.正确的操作顺序是( )
| A. | ①②③④② | B. | ②④①②③ | C. | ④②③①② | D. | ②④②③① |
10.知反应:A(g)+B(g)?C(g)+D(g)的能量变化如图所示,下列说法正确的是( )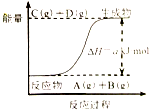

| A. | 若此反应过程中有电子转移,可设计成原电池 | |
| B. | 当A、B、C、D的浓度相同时,反应处于平衡状态 | |
| C. | 当A的消耗速率与C的消耗速率相同时处于平衡状态 | |
| D. | 该反应只有在加热条件下才能进行 |
17.某研究性学习小组查阅资料得知,漂白粉与硫酸溶液反应可制取Cl2,化学方程式为:Ca(ClO)2+CaCl2+2H2SO4 $\frac{\underline{\;\;△\;\;}}{\;}$2CaSO4+2Cl2↑+2H2O,他们设计了如下实验用于制取Cl2并验证其某些性质.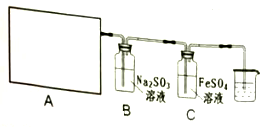
请回答:
(1)该实验中A部分的装置是②(填写装置的序号).
(2)若要证明B中Na2SO3溶液已被氧化,所需要的化学试剂为BaCl2溶液、稀盐酸;
(3)实验进行了一段时间后,他们要探究C中FeSO4溶液被氧化的程度,设计了以下的方案,请填写其中的空白:
(4)完成酸性KMnO4溶液滴入FeSO4溶液中的离子反应方程式:
1Mn${O}_{4}^{-}$+5Fe2++8H+=1Mn2++5Fe3++4H2O.

请回答:
(1)该实验中A部分的装置是②(填写装置的序号).

(2)若要证明B中Na2SO3溶液已被氧化,所需要的化学试剂为BaCl2溶液、稀盐酸;
(3)实验进行了一段时间后,他们要探究C中FeSO4溶液被氧化的程度,设计了以下的方案,请填写其中的空白:
| 实验目的 | 操作与结论 |
| ①FeSO4溶液完全未被氧化 | 实验①取少许溶液于试管中,滴入数滴KSCN溶液,若溶液不变色(选填“不变色”或“变红色”),说明溶液完全未被氧化. |
| ②FeSO4部分被氧化 | ②实验②:取少许溶液于试管中,滴入数滴酸性KMnO4溶液,若溶液褪色;再另取少许溶液于试管中,滴加几滴KSCN溶液,溶液变 红(血红)色,说明溶液被部分氧化. |
| ③FeSO4完全被氧化 | ③重复实验②在待测②液中滴加数滴酸性KMnO4溶液后,溶液不褪色,另一实验现象与②同. |
1Mn${O}_{4}^{-}$+5Fe2++8H+=1Mn2++5Fe3++4H2O.
14.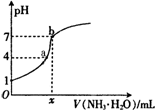 向20.00mL稀H2SO4中逐滴加入0.10mol/L的氨水,测得溶液的pH随加入氨水的体积变化如图所示.下列判断正确的是( )
向20.00mL稀H2SO4中逐滴加入0.10mol/L的氨水,测得溶液的pH随加入氨水的体积变化如图所示.下列判断正确的是( )
 向20.00mL稀H2SO4中逐滴加入0.10mol/L的氨水,测得溶液的pH随加入氨水的体积变化如图所示.下列判断正确的是( )
向20.00mL稀H2SO4中逐滴加入0.10mol/L的氨水,测得溶液的pH随加入氨水的体积变化如图所示.下列判断正确的是( )| A. | x=20 | B. | 稀H2SO4的浓度为0.10mol/L | ||
| C. | b点有:2c(NH4+)=c(SO42-)>c(H+)=c(OH-) | D. | a点有:c(NH4+)<2c(SO42-) |
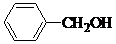 、
、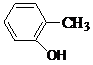 、
、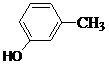 、
、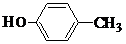 .
. .
.