题目内容
6.下列关于分子或晶体中心原子的杂化类型的说法正确的是( )| A. | CH3CH3中的两个碳原子与BF3中的硼原子均采取sp2杂化 | |
| B. | 晶体硅和石英晶体中的硅原子均采取sp3杂化 | |
| C. | BeCl2中的铍原子和H2O中的氧原子均采取sp杂化 | |
| D. | CO2中的碳原子与CH2=CH2中的两个碳原子均采取sp杂化 |
分析 根据价层电子对互斥理论确定中心原子杂化类型,价层电子对个数=σ键个数+孤电子对个数,σ键个数=配原子个数,孤电子对个数=$\frac{1}{2}$(a-xb),a指中心原子价电子个数,x指配原子个数,b指配原子形成稳定结构需要的电子个数.中心原子的杂化类型为sp3,说明该分子中心原子的价层电子对个数是4,sp2杂化,说明该分子中心原子的价层电子对个数是3,sp杂化,说明该分子中心原子的价层电子对个数是2,据此判断.
解答 解:A.CH3CH3分子中C原子价层电子对个数=4+$\frac{1}{2}$×(4-4×1)=4,为sp3杂化,BF3分子中硼原子价层电子对个数=3+$\frac{1}{2}$×(3-3×1)=3,所以采取sp2杂化,故A错误;
B.晶体硅中的硅原子平均每个硅原子与四个邻近硅原子生成四个共价键,形成4个σ键,无孤电子对,硅原子杂化轨道数=σ键数+孤对电子对数=4+0=4,所以采取sp3杂化,石英晶体成分为二氧化硅,是原子晶体,硅原子通过Si-O共价键形成4个σ键,无孤电子对,硅原子杂化轨道数=σ键数+孤对电子对数=4+0=4,硅原子采取sp3杂化,故B正确;
C.BeCl2中价层电子对个数=σ键个数+孤电子对个数=2+$\frac{1}{2}$×(2-2×1)=2,中心原子是以sp杂化,H2O中O原子的价层电子对个数=2+$\frac{1}{2}$(6-2×1)=4,所以O原子采用sp3杂化,故C错误;
D.二氧化碳分子中价层电子对个数=σ键个数+孤电子对个数=2+$\frac{1}{2}$(4-2×2)=2,采取sp杂化方式,C2H4分子中每个碳原子价层电子对个数=σ键个数+孤电子对个数=3+$\frac{1}{2}$(4-2×2)=3,所以采取sp2杂化,故D错误;
故选B.
点评 本题考查了原子杂化方式的判断,根据价层电子对互斥理论来分析解答即可,明确价层电子对个数=σ键个数+孤电子对个数,σ键个数=配原子个数,孤电子对个数=$\frac{1}{2}$(a-xb)中各个字母的含义是解本题的关键,题目难度中等.

 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案| A. | 升高温度 | B. | 分离出HI | C. | 充入H2 | D. | 充入He |
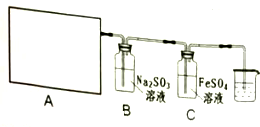
请回答:
(1)该实验中A部分的装置是②(填写装置的序号).
(2)若要证明B中Na2SO3溶液已被氧化,所需要的化学试剂为BaCl2溶液、稀盐酸;
(3)实验进行了一段时间后,他们要探究C中FeSO4溶液被氧化的程度,设计了以下的方案,请填写其中的空白:
| 实验目的 | 操作与结论 |
| ①FeSO4溶液完全未被氧化 | 实验①取少许溶液于试管中,滴入数滴KSCN溶液,若溶液不变色(选填“不变色”或“变红色”),说明溶液完全未被氧化. |
| ②FeSO4部分被氧化 | ②实验②:取少许溶液于试管中,滴入数滴酸性KMnO4溶液,若溶液褪色;再另取少许溶液于试管中,滴加几滴KSCN溶液,溶液变 红(血红)色,说明溶液被部分氧化. |
| ③FeSO4完全被氧化 | ③重复实验②在待测②液中滴加数滴酸性KMnO4溶液后,溶液不褪色,另一实验现象与②同. |
1Mn${O}_{4}^{-}$+5Fe2++8H+=1Mn2++5Fe3++4H2O.
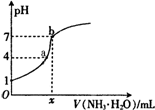 向20.00mL稀H2SO4中逐滴加入0.10mol/L的氨水,测得溶液的pH随加入氨水的体积变化如图所示.下列判断正确的是( )
向20.00mL稀H2SO4中逐滴加入0.10mol/L的氨水,测得溶液的pH随加入氨水的体积变化如图所示.下列判断正确的是( )| A. | x=20 | B. | 稀H2SO4的浓度为0.10mol/L | ||
| C. | b点有:2c(NH4+)=c(SO42-)>c(H+)=c(OH-) | D. | a点有:c(NH4+)<2c(SO42-) |
| A. | C5H10 | B. | CH4 | C. | C2H4O2 | D. | C2H4Cl2 |
| A. | 苯酚 | B. | 二氧化硫 | C. | 氯化氢 | D. | 氯气 |
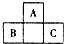 如图所示是元素周期表中短周期的一部分,已知B原子与C原子核外电子总数为A原子核外电子总数的4倍,则下列推断正确的是( )
如图所示是元素周期表中短周期的一部分,已知B原子与C原子核外电子总数为A原子核外电子总数的4倍,则下列推断正确的是( )| A. | A、B、C三者均为非金属元素 | B. | B与C只能形成一种共价化合物 | ||
| C. | A与B、A与C均可形成离子化合物 | D. | A、B、C三者最外层电子数之和为40 |
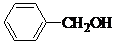 、
、 、
、 、
、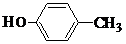 .
. .
.