题目内容
【题目】早期发现的一种天然二十面体准晶颗粒由Al、Ca、Cu、Fe 四种金属元素组成,回答下列问题:
(1)基态 Fe原子有________个未成对电子,Fe3+的价电子排布式为________。
(2)新制的Cu(OH)2可将乙醛氧化成乙酸,而自身还原成Cu2O。乙醛分子中含有的σ键与π键的比值为_____。乙醛中碳原子的杂化轨道类型为____,配合物[Cu(NH3)4](OH)2中含有的化学键类型有_____。
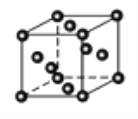
(3)Cu2O为半导体材料,在其立方晶胞内部有4个氧原子,其余氧原子位于面心和顶点,则该晶胞中有____个铜原子;金属铜采取如图甲所示堆积方式,可称为_____堆积。。
(4)CaCl2熔点高于AlCl3的原因________。
(5)CaF2晶胞如图乙所示,已知:氟化钙晶体密度为ρg·cm-3 , NA代表阿伏加德罗常数的值。氟化钙晶体中Ca2+和F-之间最近核间距(d)为________cm(只要求列出计算式即可)。
 (甲)
(甲) 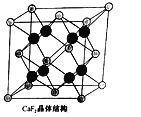 (乙)
(乙)
【答案】4; 3d5 6: 1 sp2;sp3 离子键、共价键、配位键 16 面心立方最密 CaCl2是离子晶体,AlCl3是分子晶体 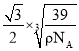
【解析】
(1)基态铁原子价电子排布式为3d64s2,d能级最多容纳10个电子,因此有4个未成对电子,Fe3+的价电子排布式为3d5;
(2)乙醛结构简式为![]() ,成键原子之间只能形成一个σ键,双键之间有一个π键,1mol乙醛中σ键有6个,1个π键,因此比值为6:1;乙醛中甲基上的C有4个σ键,无孤电子对,C杂化类型为sp3,醛基上的C有3个σ键,无孤电子对,杂化类型为sp2;Cu2+与NH3构成配位键,N和H、O和H以共价键构成,[Cu(NH3)4]2+和OH-以离子键的形式存在;
,成键原子之间只能形成一个σ键,双键之间有一个π键,1mol乙醛中σ键有6个,1个π键,因此比值为6:1;乙醛中甲基上的C有4个σ键,无孤电子对,C杂化类型为sp3,醛基上的C有3个σ键,无孤电子对,杂化类型为sp2;Cu2+与NH3构成配位键,N和H、O和H以共价键构成,[Cu(NH3)4]2+和OH-以离子键的形式存在;
(3)根据均摊的方法,氧原子的个数为(4+8×1/8+6×1/2)=8,氧化亚铜的化学式为Cu2O,因此Cu原子个数为16;根据甲晶胞图,金属铜采取面心立方最密堆积;
(4)CaCl2为离子晶体,AlCl3为分子晶体,一般离子晶体熔沸点高于分子晶体,因此CaCl2的熔沸点比AlCl3高;
(5) 白球位于顶点和面心,白球的个数为8×1/8+6×1/2=4,黑球完全在晶胞内部,即有8个,根据氟化钙的化学式,得出白球为Ca2+,黑球为F-,晶胞的质量为![]() ,令晶胞的边长为acm,则晶胞的体积为a3cm3,依据密度的定义,得出a=
,令晶胞的边长为acm,则晶胞的体积为a3cm3,依据密度的定义,得出a=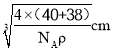 ,Ca2+和F-最近的核间距是体对角线的1/4,因此最近的核间距为
,Ca2+和F-最近的核间距是体对角线的1/4,因此最近的核间距为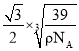 cm。
cm。

 阅读快车系列答案
阅读快车系列答案【题目】某小组为探究Cl2、Br2、I2的氧化性强弱,设计实验如下:
资料:稀溴水呈黄色;浓溴水呈红棕色;碘水呈棕黄色。
实验Ⅰ |
|
实验Ⅱ | 取ⅰ中的黄色溶液少许,加入KI溶液,再加入淀粉溶液。 |
(1)ⅰ中反应的离子方程式是__________________________________________。
(2)实验Ⅰ中ⅰ和ⅱ可以得出的结论是__________________________________。
(3)①甲同学认为:实验Ⅱ观察到__________________现象,得出氧化性Br2>I2。
②乙同学对上述实验进行反思,认为实验Ⅱ不能充分证明氧化性Br2>I2,他补做了实验Ⅲ。
实验Ⅲ | 另取ⅰ中的黄色溶液少许,先加入足量的NaBr固体,充分振荡,然后加入KI溶液和淀粉溶液。 |
补做实验Ⅲ的目的是___________________________________________________。
(4)综合实验Ⅰ和Ⅲ,得出Cl2、Br2、I2氧化性由强到弱的顺序为_____________。
(5)实验室的氯水都是实验前新制备,其制备的方法是将氯气通往蒸馏水中使其充分溶解而得到。实验室可用如图装置来制备氯水,下列对于该实验说法正确的是___________。

A.甲装置中所用药品为浓盐酸和二氧化锰
B.若在装置乙、丙之间增加一个如图(a)所示装置,制备的氯水更纯净
C.为提高氯水的制备效率,可在丙装置中的长玻璃管下端接一个如图(b)所示的多孔球
D.为了充分吸收尾气并防止倒吸,丁装置可选用如图(c)所示装置
【题目】随着科学技术的发展和环保要求的不断提高,CO2的捕集利用技术成为研究的重点。完成下列填空:
(1)目前国际空间站处理CO2的一个重要方法是将CO2还原,所涉及的反应方程式为:CO2(g)+4H2(g)![]() CH4(g)+2H2O(g),已知H2的体积分数随温度的升高而增加.若温度从300℃升至400℃,重新达到平衡,判断下列表格中各物理量的变化。(选填“增大”、“减小”或“不变”)
CH4(g)+2H2O(g),已知H2的体积分数随温度的升高而增加.若温度从300℃升至400℃,重新达到平衡,判断下列表格中各物理量的变化。(选填“增大”、“减小”或“不变”)
v正 | v逆 | 平衡常数K | 转化率α |
________ | ________ | ________ | ________ |
(2)相同温度时,上述反应在不同起始浓度下分别达到平衡,各物质的平衡浓度如下表:
[CO2]/molL﹣1 | [H2]/molL﹣1 | [CH4]/molL﹣1 | [H2O]/molL﹣1 | |
平衡Ⅰ | a | b | c | d |
平衡Ⅱ | m | n | x | y |
a、b、c、d与m、n、x、y之间的关系式为________.
(3)碳酸:H2CO3 , K1=4.3×10﹣7 , K2=5.6×10﹣11 草酸:H2C2O4 , K1=5.9×10﹣2 , K2=6.4×10﹣5 ,0.1mol/LNa2CO3溶液的pH____0.1mol/LNa2C2O4溶液的pH,(选填“大于”“小于”或“等于”),等浓度的草酸溶液和碳酸溶液中,氢离子浓度较大的是___.
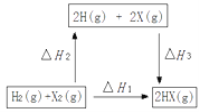
(4)在如图的转化关系中(X代表卤素)。ΔH2_____0(填“>”、“=”或“<”);△H1、△H2和△H3三者存在的关系为_______。
(5)现有浓度均为0.1mol·L-1的下列溶液:①硫酸、②醋酸、③氢氧化钠、④醋酸钠。请回答下列问题:
①醋酸钠中各离子浓度由大到小的顺序是_______。
②醋酸和醋酸钠等体积混合所得溶液中:c(CH3COOH)+c(CH3COO-)=______mol·L-1。
【题目】(1)将不同量的CO(g)和H2O(g)分别通入体积为2 L的恒容密闭容器中,进行反应CO(g)+H2O(g)![]() CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
H2O | CO | H2 | CO | |||
1 | 650 | 2 | 4 | 1.6 | 2.4 | 6 |
2 | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
3 | 900 | a | b | c | d | t |
①实验1中从反应开始至平衡以CO2表示的平均反应速率为v(CO2)=____(取小数点后两位,下同)。
②该反应的正反应为___(填“吸”或“放”)热反应,实验2条件下平衡常数K=___。
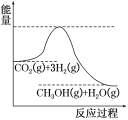
(2)目前工业上有一种方法是用CO2来生产甲醇。一定条件下发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ·mol-1)的变化。在体积为1L的恒容密闭容器中,充入1molCO2和3molH2,达到平衡后下列措施中能使c(CH3OH)增大的是____。
CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ·mol-1)的变化。在体积为1L的恒容密闭容器中,充入1molCO2和3molH2,达到平衡后下列措施中能使c(CH3OH)增大的是____。
a.升高温度 b.充入He(g),使体系压强增大
c.将H2O(g)从体系中分离出来 d.再充入1 mol CO2和3 mol H2