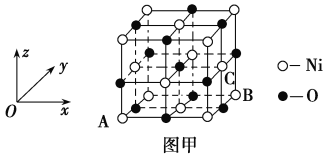
��Ŀ����
����Ŀ����ͼ��ʵ�����Ʊ�����������һϵ�����ʵ���װ�ã��гּ������������ԣ���
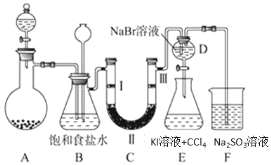
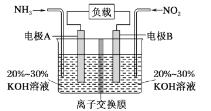
��1��װ��C��ʵ��Ŀ������֤�����Ƿ����Ư���ԣ�Ϊ��C���������������η�______
a | b | c | d | |
�� | �������ɫ���� | �������ɫ���� | ʪ�����ɫ���� | ʪ�����ɫ���� |
�� | ��ʯ�� | ��ˮ�Ȼ��� | Ũ���� | ��ˮ�Ȼ��� |
�� | ʪ�����ɫ���� | ʪ�����ɫ���� | �������ɫ���� | �������ɫ���� |
��2�����װ��D��E��Ŀ���DZȽ��ȡ��塢�ⵥ�ʵ�������ǿ��������D�л���ͨ��һ����������ʱ�����Կ�����ɫ��Һ��Ϊ�Ȼ�ɫ����������װ��D��������Һ����װ��E�У����۲쵽���������²���Һ����ɫ����֤�����嵥�ʵ�������ǿ�ڵⵥ�ʣ�������ͬѧ�Ըý���������飬����������___________��
��3���ձ�F�е� ����������Һ��������β�������ʵ�鷽����֤β�����պ���Һ�к��� SO42-_____��
���𰸡�d Dװ�����ܽ��˹�����Cl2��Cl2��I��������I2 ȡ����F�е���Һ������������ϡ���ᣬ�ټ���BaCl2��Һ��ϡ������BaCl2��Һ˳����Ե�������������ɫ����֤������SO42��
��������
��1������������Ũ�����ڼ��������·�Ӧ�����Ȼ��̡�������ˮ�������ӷ�����Ӧ��ȡ�������к����Ȼ��⣬װ��B�б���ʳ��ˮ�������dz�ȥCl2�е�HCl��װ��C��ʵ��Ŀ������֤�����Ƿ����Ư���ԣ���֤�����Ƿ����Ư���ԣ�Ҫ��֤����������Ư���ԣ�ʪ�����ɫ�����У�������ˮ��Ӧ���ɴ��������Ư���ԣ�ѡ����abcd�Ģ��ж��Ǹ��������ͨ��ʪ�����ɫ����������֤������Ư���ԣ�����C��I��II��III���η���ʪ�����ɫ��������ˮ�Ȼ��ơ��������ɫ����������ѡd����2��D��E��Ŀ���DZȽ��ȡ��塢��ķǽ����ԣ�D�з���������NaBr�ķ�Ӧ�����壬��������װ��D��������Һ����װ��E�У��������������KI��Ӧ���ɵ⣬��E�е����������Ȼ�̼��������Һ�ֲ㣬�ϲ�ӽ���ɫ���²㣨���Ȼ�̼�㣩Ϊ�Ϻ�ɫ����������˵����ķǽ�����ǿ�ڵ⣬��Ϊ����������Ҳǿ�ڵ⣬����������Ҳ�ɽ���������������3���������������Ʒ�Ӧ�����Ȼ��ƺ������ƣ���ѧ����ʽ��Cl2+2Na2SO3=2NaCl+Na2SO4, ȡ����F�е���Һ������������ϡ���ᣬ�ټ���B aCl2��Һ��ϡ������BaCl2��Һ˳����Ե�������������ɫ����֤������SO42����
(1)�������������֪��Ҫ���������Ƿ����Ư���ԣ���Ҫ��֤����������Ư���ԣ�ʪ��������Ư���ԣ�����Ϊʪ�����ɫ�����У�������ˮ��Ӧ���ɴ��������Ư���ԣ�ѡ����abcd�Ģ��ж��Ǹ�����������������ü�ʯ�Ҹ����a��ѡ����ͨʪ�����ɫ��������b��ѡ��������ȷ��˳������C��I��II��III���η���ʪ�����ɫ��������ˮ�Ȼ��ơ��������ɫ����������ѡd���𰸣�d��
��2��D��Eʵ���Ŀ���DZȽ��ȡ��塢��ķǽ����ԣ�D�з���������NaBr�ķ�Ӧ�����壬��������װ��D��������Һ����װ��E�У��������������KI��Ӧ���ɵ⣬��E�е����������Ȼ�̼��������Һ�ֲ㣬�ϲ�ӽ���ɫ���²㣨���Ȼ�̼�㣩Ϊ�Ϻ�ɫ����������˵����ķǽ�����ǿ�ڵ⣬��Ϊ����������Ҳǿ�ڵ⣬����������Ҳ�ɽ��������������𰸣�Dװ�����ܽ��˹�����Cl2��Cl2��I��������I2��
��3���������������Ʒ�Ӧ�����Ȼ��ƺ������ƣ���ѧ����ʽ��Cl2+2Na2SO3=2NaCl+Na2SO4, Ҫ����ȡ����F�е���Һ������������ϡ���ᣬ�ټ���BaCl2��Һ��ϡ������BaCl2��Һ˳����Ե�������������ɫ����֤������SO42�����𰸣�ȡ����F�е���Һ������������ϡ���ᣬ�ټ���BaCl2��Һ��ϡ������BaCl2��Һ˳����Ե�������������ɫ����֤������SO42����

����Ŀ�����ſ�ѧ�����ķ�չ�ͻ���Ҫ��IJ�����ߣ�CO2�IJ������ü�����Ϊ�о����ص㡣���������գ�
��1��Ŀǰ���ʿռ�վ����CO2��һ����Ҫ�����ǽ�CO2��ԭ�����漰�ķ�Ӧ����ʽΪ��CO2��g��+4H2��g��![]() CH4��g��+2H2O��g������֪H2������������¶ȵ����߶����ӣ����¶ȴ�300������400�棬���´ﵽƽ�⣬�ж����б����и��������ı仯����ѡ����������������С��������������
CH4��g��+2H2O��g������֪H2������������¶ȵ����߶����ӣ����¶ȴ�300������400�棬���´ﵽƽ�⣬�ж����б����и��������ı仯����ѡ����������������С��������������
v�� | v�� | ƽ�ⳣ��K | ת������ |
________ | ________ | ________ | ________ |
��2����ͬ�¶�ʱ��������Ӧ�ڲ�ͬ��ʼŨ���·ֱ�ﵽƽ�⣬�����ʵ�ƽ��Ũ�����±���
[CO2]/molL��1 | [H2]/molL��1 | [CH4]/molL��1 | [H2O]/molL��1 | |
ƽ��� | a | b | c | d |
ƽ��� | m | n | x | y |
a��b��c��d��m��n��x��y֮��Ĺ�ϵʽΪ________��
��3��̼�H2CO3 �� K1=4.3��10��7 �� K2=5.6��10��11 ���H2C2O4 �� K1=5.9��10��2 �� K2=6.4��10��5 ,0.1mol/LNa2CO3��Һ��pH____0.1mol/LNa2C2O4��Һ��pH����ѡ������������С��������������������Ũ�ȵIJ�����Һ��̼����Һ�У�������Ũ�Ƚϴ����___��
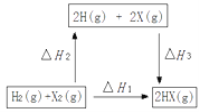
��4������ͼ��ת����ϵ��(X����±��)����H2_____0(������������������������)����H1����H2�͡�H3���ߴ��ڵĹ�ϵΪ_______��
��5������Ũ�Ⱦ�Ϊ0.1mol��L-1��������Һ�������ᡢ�ڴ��ᡢ���������ơ��ܴ����ơ���ش��������⣺
�ٴ������и�����Ũ���ɴ�С��˳����_______��
�ڴ���ʹ����Ƶ�������������Һ�У�c(CH3COOH)��c(CH3COO��)��______mol��L-1��