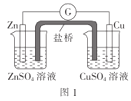
题目内容
【题目】硝酸厂的烟气中含有一定量的氮氧化物(NOx),通常要将烟气中的氮氧化物转化为无毒无害的物质即脱硝。
(1)用空气-水脱硝的方法是最经济的方法。
已知:①2NO(g)+O2(g)=2NO2(g)△H1=-123.4kJ·mol-1
②3NO2(g)+H2O(1)=2HNO3(aq)+NO(g)△H2=-73.6kJ·mol-1
写出NO(g)、O2(g)和液体水反应生成HNO3(aq)的热化学方程式______。
(2)吸收电解法是脱硝的种重要方法。先用稀硝酸吸收NOx、反应生成HNO2(一元弱酸),再将吸收液加入电解槽中进行电解,使之转化为硝酸,其电解装置如下图所示。

①图中a应连接电源的________(正极或负极),其电极反应式为_____。
②电解过程中总反应的化学方程式是_____。有10 mol HNO2参加反应.氧化产物的物质的量是_____。
③阴极区产生1mol氮气时,理论上阳极区减少H+的物质的量约为_____。
【答案】4NO(g)+3O2(g)+2H2O(l)=4HNO3(aq) △H=-517.4kJ/mol 正极 HNO2+H2O-2e-=NO3-+3H+ 5HNO2![]() 3HNO3+N2↑+H2O 6mol 10mol
3HNO3+N2↑+H2O 6mol 10mol
【解析】
(1)已知:①2NO(g)+O2(g)=2NO2(g)△H1=-123.4kJ·mol-1
②3NO2(g)+H2O(1)=2HNO3(aq)+NO(g)△H2=-73.6kJ·mol-1
根据盖斯定律可知,将2×②+①×3,可得4NO2(g)+3O2(g)+2H2O(l)=4HNO3(aq),△H=2×△H2+△H1×3=(-73.6 kJmol-1)×2+(-123.4 kJmol-1)×3=-517.4kJmol-1;
(2)①a电极上亚硝酸失电子生成硝酸,所以a为阳极,b为阴极,则a与电源的正极相连;阳极上亚硝酸失电子生成硝酸,其电极方程式为:H2O+HNO2-2e-=NO3-+3H+;
②阳极上亚硝酸失电子生成硝酸,其电极方程式为:5H2O+5HNO2-10e-=5NO3-+15H+;阴极生成氮气,反应式为2NO3-+10e-+12H+= N2↑+6H2O,两式相加得电解过程中总反应的化学方程式为:5HNO2 3HNO3+N2↑+H2O,化合价升高的产物为氧化产物,即硝酸,根据总反应的化学方程式的比列关系可知有10 mol HNO2参加反应,氧化产物的物质的量是6 mol;
3HNO3+N2↑+H2O,化合价升高的产物为氧化产物,即硝酸,根据总反应的化学方程式的比列关系可知有10 mol HNO2参加反应,氧化产物的物质的量是6 mol;
③阴极反应式为2NO3-+10e-+12H+=N2↑+6H2O,所以阴极区产生1mol氮气时,转移电子为10mol,则有10molH+从阳极室进入阴极室,即理论上阳极区减少H+的物质的量约为10mol。

【题目】某温度下,分别在下列容积为2L的恒容绝热密闭容器中,发生如下反应: 2CO(g)+SO2(g)=S(g)+2CO2(g) △H>0。测得相关数据如下表所示。
容器 | 起始时物质的量 | 平衡时CO(g)的浓度/mol·L | |||
CO(g) | SO2(g) | S(g) | CO2(g) | ||
甲 | 1 | 0.5 | 0.5 | 1 | a |
乙 | 1 | 0.5 | 0 | 0 | 0.2 |
丙 | 0 | 0 | 1 | 2 | b |
下列说法正确的是
A.平衡常数:K甲>K乙
B.a=0.4
C.若乙容器l0min达到平衡.则用S(g)表示的反应速率为0.005molL-1min-1
D.若将丙容器改为恒压绝热容器,则达到平衡时b=0.2