题目内容
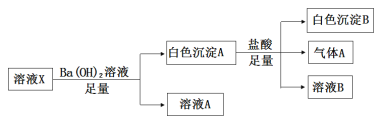
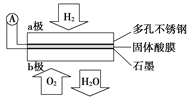
【题目】某固体酸燃料电池以Ca(HSO4)2固体为电解质传递H+,其基本结构见下图,电池总反应可表示为2H2+O2=2H2O,下列有关说法正确的是( )

A. 电子通过外电路从b极流向a极
B. b极上的电极反应式为:O2+2H2O+4e-=4OH-
C. H+由a极通过固体酸电解质传递到b极
D. 每转移0.2 mol电子,消耗1.12 L的H2
【答案】C
【解析】
A.因氢元素的化合价升高,则通入氢气的电极a为负极,这样电子应该是通过外电路由a极流向b,A错误;
B.该电池为酸性电池,反应为O2+4e-+4H+=2H2O,B错误;
C.原电池中,阳离子向正极移动,所以H+由a极通过固体酸电解质传递到b极,C正确;
D.因没有说明是否为标准状况,则气体的体积不一定为1.12L,D错误;
故合理选项是C。

 激活思维优加课堂系列答案
激活思维优加课堂系列答案 活力试卷系列答案
活力试卷系列答案【题目】已知,25 ℃时几种弱酸的电离常数如表所示:
弱酸 | 电离常数 | 弱酸 | 电离常数 |
H2CO3 | Ka1=4.3×10-7 Ka2=5.6×10-11 | H2C2O4 (草酸) | Ka1=5.9×10-2 Ka2=6.4×10-5 |
H3PO4 | Ka1=7.1×10-3 Ka2=6.3×10-8 Ka3=4.2×10-13 | H3C6H5O7 (柠檬酸) | Ka1=7.4×10-4 Ka2=1.7×10-5 Ka3=4.0×10-7 |
下列有关推断正确的是( )
A. 溶液pH的大小关系为K3PO4>K2HPO4>KH2PO4
B. 在Na2CO3溶液中存在:c(OH-)- c(H+)=c(HCO3-)+ c(H2CO3)
C. 等浓度的NaHCO3、NaHC2O4溶液中前者pH较大
D. H3C6H5O7与Na2CO3溶液反应的产物为Na3C6H5O7、CO2、H2O
【题目】下表是元素周期表的一部分,请回答有关问题:
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
2 | ① | ② | ③ | |||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
4 | ⑨ | ⑩ |
(1)表中化学性质最不活泼的元素,其原子结构示意图为 ________________________ 。
(2)表中能形成两性氢氧化物的元素是 ________ (/span>用元素符号表示),写出该元素的单质与⑨最高价氧化物的水化物反应的离子方程式 ________________________ 。
(3)④元素与⑦元素形成化合物的电子式 _____________________________ 。
(4)①、②、⑥、⑦四种元素的最高价氧化物的水化物中酸性最强的是 ____(填化学式)。
(5)③元素与⑩元素两者核电荷数之差是 ____________ 。