题目内容
某一反应体系中,有反应物和生成物共六种物质,这六种物质是:Cl2、KMnO4、MnCl2、H2O、HCl(浓)、KCl,其中Cl2、H2O均为生成物.
(1)该反应中的氧化剂是 ,氧化产物为 .
(2)该反应中,氧化产物与还原产物的物质的量之比为 .
(3)完成该反应的化学方程式2KMnO4+16HCl(浓)═ .
(4)若产生的气体在标准状况下体积为2.24L,则反应过程中转移电子的数目为 ,发生反应的KMnO4的质量为 g.
(1)该反应中的氧化剂是
(2)该反应中,氧化产物与还原产物的物质的量之比为
(3)完成该反应的化学方程式2KMnO4+16HCl(浓)═
(4)若产生的气体在标准状况下体积为2.24L,则反应过程中转移电子的数目为
考点:氧化还原反应的计算,氧化还原反应
专题:氧化还原反应专题
分析:(1)化合价升高元素失去电子,被氧化,所在反应物是还原剂,对应产物是氧化产物;化合价降低元素得到电子,被还原,所在的反应物是氧化剂,对应产物是还原产物;
(2)根据化学方程式的系数来回答;
(3)根据得失电子守恒和质量守恒来配平;
(4)根据化学方程式以及反应转移电子的情况计算即可.
(2)根据化学方程式的系数来回答;
(3)根据得失电子守恒和质量守恒来配平;
(4)根据化学方程式以及反应转移电子的情况计算即可.
解答:
解:(1)高锰酸钾中的锰元素处于最高价,只有氧化性,能将HCl氧化,HCl是还原剂,对应的产物Cl2是氧化产物,故答案为:KMnO4; Cl2;
(2)根据电子守恒配平高锰酸钾氧化HCl的化学方程式为:2KMnO4+16HCl(浓)=2MnCl2+8H2O+2KCl+5Cl2,氧化产物是氯气,还原产物是MnCl2,物质的量之比为5:2,故答案为:5:2;
(3)KMnO4中的锰的化合价由+7价变成+2价,盐酸中的氯由-1价变成0价,然后根据化合价升降相等,配平得:2KMnO4+16 HCl (浓)=2 KCl+2 MnCl2+5Cl2↑+8H2O,故答案为:2KCl+2MnCl2+5Cl2↑+8H2O;
(4)根据化学方程式:2KMnO4+16HCl(浓)=2MnCl2+8H2O+2KCl+5Cl2,当生成5mol的氯气时,消耗高锰酸钾2mol,转移电子10mol,当产生的气体在标准状况下体积为2.24L,即生成氯气是0.1mol时,消耗高锰酸钾0.04mol,则反应过程中转移电子0.2mol,即0.2NA个,发生反应的KMnO4的质量为0.04mol×158g/mol=6.32g,故答案为:0.2;6.32.
(2)根据电子守恒配平高锰酸钾氧化HCl的化学方程式为:2KMnO4+16HCl(浓)=2MnCl2+8H2O+2KCl+5Cl2,氧化产物是氯气,还原产物是MnCl2,物质的量之比为5:2,故答案为:5:2;
(3)KMnO4中的锰的化合价由+7价变成+2价,盐酸中的氯由-1价变成0价,然后根据化合价升降相等,配平得:2KMnO4+16 HCl (浓)=2 KCl+2 MnCl2+5Cl2↑+8H2O,故答案为:2KCl+2MnCl2+5Cl2↑+8H2O;
(4)根据化学方程式:2KMnO4+16HCl(浓)=2MnCl2+8H2O+2KCl+5Cl2,当生成5mol的氯气时,消耗高锰酸钾2mol,转移电子10mol,当产生的气体在标准状况下体积为2.24L,即生成氯气是0.1mol时,消耗高锰酸钾0.04mol,则反应过程中转移电子0.2mol,即0.2NA个,发生反应的KMnO4的质量为0.04mol×158g/mol=6.32g,故答案为:0.2;6.32.
点评:本题考查学生氧化还原反应中的基本概念和电子转移知识,综合性较强,难度较大.

练习册系列答案
相关题目
化合物AB中含36.36% B,化合物BC2中含50% B,则化合物ABC4中含B为( )
| A、12.64% |
| B、14.09% |
| C、19.56% |
| D、21.1% |
下列事实能说明氯的非金属性比硫强的是( )
| A、铁与硫反应生成硫化亚铁,而铁与氯气反应时生成氯化铁 |
| B、与金属钠反应,氯原子得一个电子,而硫原子能得两个电子 |
| C、常温时氯气呈气态,而硫呈现固态 |
| D、氯的最高价为+7价,而硫的最高价为+6价 |
已知X+、Y2+、Z-、W2-四种离子均具有相同的电子层结构.下列关于X、Y、Z、W四种元素的描述,正确的是( )
| A、原子半径:X>Y>Z>W |
| B、原子序数:Y>X>W>Z |
| C、原子最外层电子数:Y>X>Z>W |
| D、金属性:X>Y,还原性:W2->Z- |
在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
下列说法错误的是( )
| 物质 | X | Y | Z |
| 初始浓度(mol/L) | 0.1 | 0.2 | 0 |
| 平衡浓度(mol/L) | 0.05 | 0.15 | 0.1 |
| A、反应达到平衡时,X的转化率为50% | ||
B、反应可表示为X+Y?2Z,其平衡常数为
| ||
| C、若该反应为放热反应,升高温度,平衡常数减小 | ||
| D、增大压强使平衡向生成Z的方向移动,平衡常数不变 |
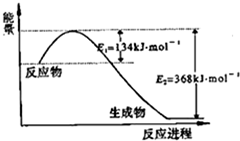 氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,减少氮的氧化物在大气中的排放是环境保护的重要内容之一.
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,减少氮的氧化物在大气中的排放是环境保护的重要内容之一.