题目内容
在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
下列说法错误的是( )
| 物质 | X | Y | Z |
| 初始浓度(mol/L) | 0.1 | 0.2 | 0 |
| 平衡浓度(mol/L) | 0.05 | 0.15 | 0.1 |
| A、反应达到平衡时,X的转化率为50% | ||
B、反应可表示为X+Y?2Z,其平衡常数为
| ||
| C、若该反应为放热反应,升高温度,平衡常数减小 | ||
| D、增大压强使平衡向生成Z的方向移动,平衡常数不变 |
考点:化学平衡的计算
专题:化学平衡专题
分析:A、转化率是消耗量除以起始量得到;
B、依据图表中的初始浓度和平衡浓度判断反应物和生成物,依据变化的浓度计算反应比写出化学方程式;
C、正向是放热反应,升温平衡逆向移动,平衡常数减小;
D、根据压强对平衡移动的影响以及影响平衡常数的因素作答;
B、依据图表中的初始浓度和平衡浓度判断反应物和生成物,依据变化的浓度计算反应比写出化学方程式;
C、正向是放热反应,升温平衡逆向移动,平衡常数减小;
D、根据压强对平衡移动的影响以及影响平衡常数的因素作答;
解答:
解:图表中分析消耗量或生成量为,消耗X浓度0.1mol/L-0.05mol/L=0.05mol/L,Y消耗浓度=0.2mol/L-0.15mol/L=0.05mol/L,Z生成浓度0.1mol/L,反应比为X:Y:Z=0.05:0.05:0.1=1:1:2,反应的化学方程式为:X+Y 2Z,
2Z,
A、依据图表分析可知,X消耗的物质的量浓度=0.1mol/L-0.05mol/L=0.05mol/L,X的转化率=
×100%=50%,故A正确;
B、消耗X浓度0.1mol/L-0.05mol/L=0.05mol/L,Y消耗浓度=0.2mol/L-0.15mol/L=0.05mol/L,Z生成浓度0.1mol/L,反应比为X:Y:Z=0.05:0.05:0.1=1:1:2,反应的化学方程式为:X+Y 2Z,平衡常数K=
2Z,平衡常数K=
=
,故B正确;
C、正向是放热反应,升温平衡逆向移动,平衡常数减小,故C正确;
D、由于该反应为气体体积不变的反应,所以增大压强,平衡不移动,故D错误;
故选D.
 2Z,
2Z,A、依据图表分析可知,X消耗的物质的量浓度=0.1mol/L-0.05mol/L=0.05mol/L,X的转化率=
| 0.05mol/L |
| 0.1mol/L |
B、消耗X浓度0.1mol/L-0.05mol/L=0.05mol/L,Y消耗浓度=0.2mol/L-0.15mol/L=0.05mol/L,Z生成浓度0.1mol/L,反应比为X:Y:Z=0.05:0.05:0.1=1:1:2,反应的化学方程式为:X+Y
 2Z,平衡常数K=
2Z,平衡常数K=| 0.12 |
| 0.05×0.15 |
| 4 |
| 3 |
C、正向是放热反应,升温平衡逆向移动,平衡常数减小,故C正确;
D、由于该反应为气体体积不变的反应,所以增大压强,平衡不移动,故D错误;
故选D.
点评:本题考查了化学平衡的有关计算,化学方程式的书写方法,化学平衡常数的计算,影响化学平衡的因素分析判断,题目难度中等,书写方程式是解题关键.

练习册系列答案
 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案
相关题目
向1mol炽热的Cu2S中通入足量的水蒸气,充分反应后生成2mol H2,则Cu2S应转化为( )
| A、Cu和SO2 |
| B、Cu和S |
| C、CuO和SO2 |
| D、Cu2O和S |
下列化学键中,都属于极性共价键的是( )
| A、共价化合物中的化学键 |
| B、离子化合物中的共价键 |
| C、同种元素原子间的共价键 |
| D、不同元素原子间的共价键 |
下列四个图示中,属于过滤操作的是( )
A、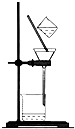 |
B、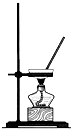 |
C、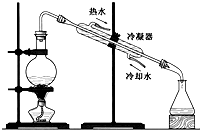 |
D、 |
 碳元素不仅能形成丰富多彩的有机化合物,而且还能形成多种无机化合物,同时自身可以形成多种单质,碳及其化合物的用途广泛.
碳元素不仅能形成丰富多彩的有机化合物,而且还能形成多种无机化合物,同时自身可以形成多种单质,碳及其化合物的用途广泛.