题目内容
铁是生活中最常见的金属之一,回答下列问题:
(1)铁制容器可以用来盛装浓硫酸的原因是
(2)用铁盐溶液可以溶解铜质线路板的离子方程式
(3)检验铁盐溶液中是否含有亚铁盐的方法是
(4)保存亚铁盐时需要加入 ,其作用是
(5)检验亚铁盐是否变质的方法是 .
(1)铁制容器可以用来盛装浓硫酸的原因是
(2)用铁盐溶液可以溶解铜质线路板的离子方程式
(3)检验铁盐溶液中是否含有亚铁盐的方法是
(4)保存亚铁盐时需要加入
(5)检验亚铁盐是否变质的方法是
考点:铁的化学性质
专题:
分析:(1)常温下,Fe遇浓硫酸发生钝化;
(2)铁离子与Cu发生氧化还原反应;
(3)亚铁离子具有还原性;
(4)亚铁离子水解,且易被氧化;
(5)亚铁盐变质混有铁离子,检验铁离子即可.
(2)铁离子与Cu发生氧化还原反应;
(3)亚铁离子具有还原性;
(4)亚铁离子水解,且易被氧化;
(5)亚铁盐变质混有铁离子,检验铁离子即可.
解答:
解:(1)铁制容器可以用来盛装浓硫酸的原因是发生钝化,生成致密的氧化膜阻止反应的进一步发生,故答案为:发生钝化,生成致密的氧化膜阻止反应的进一步发生;
(2)用铁盐溶液可以溶解铜质线路板的离子方程式为Cu+2Fe3+═Cu2++2Fe2+,故答案为:Cu+2Fe3+═Cu2++2Fe2+;
(3)检验铁盐溶液中是否含有亚铁盐的方法是加入酸性高锰酸钾溶液,高锰酸钾溶液褪色,故答案为:加入酸性高锰酸钾溶液,高锰酸钾溶液褪色;
(4)保存亚铁盐时需要加入铁粉、稀盐酸,其作用是防止亚铁离子被氧化,且抑制水解,故答案为:铁粉、稀盐酸;防止亚铁离子被氧化,且抑制水解;
(5)检验亚铁盐是否变质的方法是加KSCN溶液,变为血红色,故答案为:加KSCN溶液,变为血红色.
(2)用铁盐溶液可以溶解铜质线路板的离子方程式为Cu+2Fe3+═Cu2++2Fe2+,故答案为:Cu+2Fe3+═Cu2++2Fe2+;
(3)检验铁盐溶液中是否含有亚铁盐的方法是加入酸性高锰酸钾溶液,高锰酸钾溶液褪色,故答案为:加入酸性高锰酸钾溶液,高锰酸钾溶液褪色;
(4)保存亚铁盐时需要加入铁粉、稀盐酸,其作用是防止亚铁离子被氧化,且抑制水解,故答案为:铁粉、稀盐酸;防止亚铁离子被氧化,且抑制水解;
(5)检验亚铁盐是否变质的方法是加KSCN溶液,变为血红色,故答案为:加KSCN溶液,变为血红色.
点评:本题Fe的化学性质,为高频考点,把握Fe发生的氧化还原反应、盐类水解及离子检验为解答的关键,注重基础知识的考查,题目难度不大.

练习册系列答案
 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案
相关题目
已知:还原性HSO3->I-,氧化性IO3->I2.
实验Ⅰ:在一定量NaHSO3的溶液中逐滴加入KIO3溶液;
实验Ⅱ:在一定量的KIO3溶液中逐滴加NaHSO3溶液.
下列说法正确的是( )
实验Ⅰ:在一定量NaHSO3的溶液中逐滴加入KIO3溶液;
实验Ⅱ:在一定量的KIO3溶液中逐滴加NaHSO3溶液.
下列说法正确的是( )
| A、两个实验中溶液的pH变化趋势相同 |
| B、两实验中生成等量I2时,转移电子数的物质的量相同 |
| C、在实验Ⅰ的过程中,若NaHSO3初始量为3mol,当溶液中I-与I2的物质的量之比为5:2时,氧化产物为3.2mol |
| D、过程Ⅱ中,可以用淀粉作为滴定指示剂,判定第一阶段反应终点 |
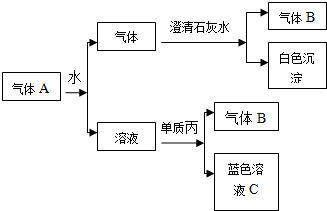 将红热固体单质甲放在显黄色的溶液乙中剧烈反应,产生混合气体A,A在常温下(不与空气接触)有如下变化:
将红热固体单质甲放在显黄色的溶液乙中剧烈反应,产生混合气体A,A在常温下(不与空气接触)有如下变化:
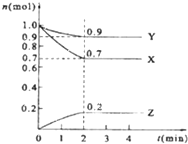 某温度时,在2L的密闭容器中,X、Y、Z三种物质的量随时间的变化曲线如图所示:
某温度时,在2L的密闭容器中,X、Y、Z三种物质的量随时间的变化曲线如图所示: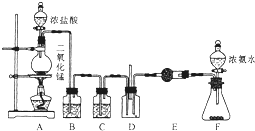 某课外活动小组用如图所示的实验装置探究氯气与氨气之间的反应.其中A、F为氯气和氨气的发生装置,D为纯净、干燥的氯气与氨气反应的装置.
某课外活动小组用如图所示的实验装置探究氯气与氨气之间的反应.其中A、F为氯气和氨气的发生装置,D为纯净、干燥的氯气与氨气反应的装置.