题目内容
下列事实能说明氯的非金属性比硫强的是( )
| A、铁与硫反应生成硫化亚铁,而铁与氯气反应时生成氯化铁 |
| B、与金属钠反应,氯原子得一个电子,而硫原子能得两个电子 |
| C、常温时氯气呈气态,而硫呈现固态 |
| D、氯的最高价为+7价,而硫的最高价为+6价 |
考点:非金属在元素周期表中的位置及其性质递变的规律
专题:元素周期律与元素周期表专题
分析:元素的非金属性越强,其单质与氢气越容易反应,其氢化物越稳定,其最高价氧化物的水化物酸性越强,其单质的氧化性越强,据此分析解答.
解答:
解:元素的非金属性越强,其单质与氢气越容易反应,其氢化物越稳定,其最高价氧化物的水化物酸性越强,其单质的氧化性越强;
氯气能将铁氧化为高价铁,S将铁氧化为低价态,说明氯气的氧化性大于硫,则氯元素的非金属性大于硫,
非金属性强弱与得电子多少、单质的状态、其最高化合价都无关,
故选A.
氯气能将铁氧化为高价铁,S将铁氧化为低价态,说明氯气的氧化性大于硫,则氯元素的非金属性大于硫,
非金属性强弱与得电子多少、单质的状态、其最高化合价都无关,
故选A.
点评:本题考查了非金属性强弱的判断,明确非金属性强弱的判断方法是解本题关键,注意:非金属性强弱与得电子难易程度有关,与得电子多少无关,为易错点.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
 某烃的结构简式如图,分子中含有四面体结构的碳原子(即饱和碳原子)数为x,在同一直线上的碳原子数为y,一定在同一平面上的碳原子数为z,则 x、y、z分别为( )
某烃的结构简式如图,分子中含有四面体结构的碳原子(即饱和碳原子)数为x,在同一直线上的碳原子数为y,一定在同一平面上的碳原子数为z,则 x、y、z分别为( )| A、4,3,5 |
| B、5,5,4 |
| C、5,3,6 |
| D、4,6,4 |
下列化合物中,含有共价键的是( )
| A、NaCl |
| B、He |
| C、NaOH |
| D、CaCl2 |
已知:还原性HSO3->I-,氧化性IO3->I2.
实验Ⅰ:在一定量NaHSO3的溶液中逐滴加入KIO3溶液;
实验Ⅱ:在一定量的KIO3溶液中逐滴加NaHSO3溶液.
下列说法正确的是( )
实验Ⅰ:在一定量NaHSO3的溶液中逐滴加入KIO3溶液;
实验Ⅱ:在一定量的KIO3溶液中逐滴加NaHSO3溶液.
下列说法正确的是( )
| A、两个实验中溶液的pH变化趋势相同 |
| B、两实验中生成等量I2时,转移电子数的物质的量相同 |
| C、在实验Ⅰ的过程中,若NaHSO3初始量为3mol,当溶液中I-与I2的物质的量之比为5:2时,氧化产物为3.2mol |
| D、过程Ⅱ中,可以用淀粉作为滴定指示剂,判定第一阶段反应终点 |
下列化学键中,都属于极性共价键的是( )
| A、共价化合物中的化学键 |
| B、离子化合物中的共价键 |
| C、同种元素原子间的共价键 |
| D、不同元素原子间的共价键 |
下列有机物的命名正确的是( )
| A、2-乙基丁烷 |
| B、3,3-二甲基丁烷 |
| C、3-甲基-2-丁烯 |
D、 1,4-二甲苯 1,4-二甲苯 |
下列四个图示中,属于过滤操作的是( )
A、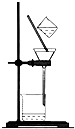 |
B、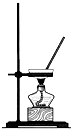 |
C、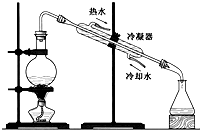 |
D、 |