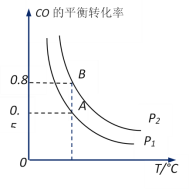
题目内容
【题目】海带具有从海水中富集碘的能力。下面是从海带中提取碘单质的流程:
海带![]() 海带灰
海带灰![]() 悬浊液
悬浊液![]() 含I-的溶液
含I-的溶液![]() 含I2的溶液
含I2的溶液![]() 含I2的四氯化碳溶液
含I2的四氯化碳溶液![]() 晶体碘
晶体碘
(1)在上述流程中,属于过滤操作的是___(用a、b、c、d表示,下同),属于萃取操作的是___。
(2)现有烧杯、玻璃棒和必需的夹持仪器,完成过滤操作尚缺少的玻璃仪器是___,完成萃取操作还需要的玻璃仪器是___。
(3)写出含I-的溶液中通氯气后发生反应的离子方程式:___。
(4)含I2的水溶液中加入四氯化碳,振荡后静置,观察到溶液分层,下层溶液显___。
(5)四氯化碳能从碘水中萃取出碘的原因是①___,②___,③___。
【答案】c d 漏斗 分液漏斗 Cl2+2I-=I2+2Cl- 紫红色 四氯化碳与水不互溶 混合时溶液分层 碘在四氯化碳中的溶解度比在水中的溶解度大得多
【解析】
由提取海带中的碘的实验流程可知,a海带在坩埚中灼烧,b为加入水溶解得到悬浊液,步骤c为过滤,得到含碘离子的溶液,通入氯气氧化碘离子得到含碘单质的溶液,d加入四氯化碳萃取分液,得到含碘单质的四氯化碳溶液,通过蒸馏提纯得到碘单质,
(1)由上面分析可知,在上述流程中,属于过滤操作的是c,属于萃取操作的是d,
故答案:c;d;
(2)步骤c的操作是过滤,用于分离固体和溶液,该操作中涉及到的玻璃仪器有漏斗、烧杯和玻璃棒,完成萃取操作还需要的玻璃仪器是分液漏斗,
故答案为:漏斗;分液漏斗;
(3)含I-的溶液中通氯气后发生反应的离子方程式:Cl2+2I-=I2+2Cl-,
故答案:Cl2+2I-=I2+2Cl-;
(4)四氯化碳比水重在溶液下层,操作时在含I2的溶液中加入四氯化碳,振荡、静置后,液体分为两层,下层液体呈紫红色,
故答案为:紫红色;
(5)四氯化碳能从碘水中萃取出碘的原因是:四氯化碳与水不互溶;混合时溶液分层;碘在四氯化碳中的溶解度比在水中的溶解度大得多,
故答案:四氯化碳与水不互溶;混合时溶液分层;碘在四氯化碳中的溶解度比在水中的溶解度大得多;

 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案