题目内容
【题目】决定物质性质的重要因素是物质结构.请回答下列问题.
(1)已知A和B为第三周期元素,其原子的第一至第四电离能如下表所示:

则,A的化合价__B的化合价(填“>”、“<”或“=”).
(2)实验证明:KCl、MgO、CaO、TiN这4种晶体的结构与NaCl晶体结构相似(如图所示),其中3种离子晶体的晶格能数据如下表:

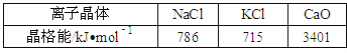
则该 4种离子晶体(不包括NaCl)熔点从高到低的顺序是:__.
(3)金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好.离子型氧化物V2O5和CrO2中,适合作录音带磁粉原料的是___________________________.
(4)某配合物的分子结构如图所示,则N原子的杂化方式为__;基态Ni原子的电子排布式__.
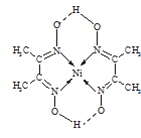
【答案】> TiN>MgO>CaO>KCl CrO2 sp2 [Ar]3d84s2
【解析】
(1)A和B为第三周期元素,由电离能数据可知A可失去3个电子,B可失去2个电子;
(2)离子晶体的晶格能越大,熔点越高;
(3)根据离子的最外层电子数判断;
(4)根据分子结构可知N形成3个δ键和1个π键,根据能量最低原理书写电子排布式。
(1)A和B为第三周期元素,由电离能数据可知A可失去3个电子,最高化合价为+3价,B可失去2个电子,最高化合价为+2价,则最高化合价A>B,
故答案为:>;
(2)离子晶体的离子半径越小,带电荷数越多,晶格能越大,则晶体的熔沸点越高,则有TiN>MgO,MgO>CaO,由表中数据可知CaO>KCl,则TiN>MgO>CaO>KCl,
故答案为:TiN>MgO>CaO>KCl;
(3)V2O5中,V的最外层电子全部失去或成键,其未成对电子数是0;CrO2中Cr失去4个电子,离子的最外层未成对电子数为2,金属阳离子的未成对电子越多磁性越大,则适合作录音带磁粉原料的是CrO2,
故答案为:CrO2;
(4)根据分子结构可知N形成3个δ键和1个π键,其杂化类型为sp2杂化,Ni的原子序数为28,其电子排布式为[Ar]3d84s2,
故答案为:sp2;[Ar]3d84s2。

【题目】向容积为2 L的密闭容器中加入足量活性炭和NO,发生反应:C(s)+2NO(g)![]() N2(g)+CO2(g),△H<0,NO和N2的物质的量变化如下表所示。
N2(g)+CO2(g),△H<0,NO和N2的物质的量变化如下表所示。
物质的量/mol | T1/℃ | T2/℃ | |||||
0 | 5 min | 10 min | 15 min | 20 min | 25 min | 30 min | |
NO | 2.0 | 1.16 | 0.80 | 0.80 | 0.50 | 0.40 | 0.40 |
N2 | 0 | 0.42 | 0.60 | 0.60 | 0.75 | 0.80 | 0.80 |
请回答下列问题:
(1) 0—5 min内,以CO2表示的该反应速率v(CO2)=____,该条件下的平衡常数K=____。
(2) 第15 min后,温度调整到T2,数据变化如上表所示,则T1___T2(填“>”、“<”或“=” )。
(3)若30 min时,保持T2不变,向该容器中再加入该四种反应混合物各2 mol,则该可逆反应最终达平衡时NO的转化率α=_______。




