题目内容
【题目】深入研究碳元素的化合物有重要意义,回答下列问题:
(1)在恒温、恒容密闭容器中加入H2C2O4,发生反应:H2C2O4(s)![]() CO2(g)+CO(g)+H2O(g),下列叙述能说明反应已经达到平衡状态的是________。
CO2(g)+CO(g)+H2O(g),下列叙述能说明反应已经达到平衡状态的是________。
A.压强不再变化
B.CO2(g)的体积分数保持不变
C.混合气体的密度不再变化
D.混合气体的平均摩尔质量保持不变
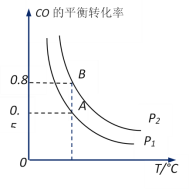
(2)工业上可以通过反应CO(g)+2H2(g)![]() CH3OH(g)制备甲醇。在一容积可变容器中充入2molCO和4molH2,CO的平衡转 化率随温度(T)、压强(P)的变化关系如图所示。该反应的H_______0(填“>”、“<”或“=”),比较A点时用CO表示的正反应速率与B点时用CH3OH表示的逆反应速率的大小v正(CO)____v逆(CH3OH)(填“>”、“<”或“=”)。若在压强P1下达到化学平衡状态A时,容器的体积为10L。如果反应开始时仍充入2molCO和4molH2,则在压强P2下达到平衡状态B时容器的体积V(B)=________L。
CH3OH(g)制备甲醇。在一容积可变容器中充入2molCO和4molH2,CO的平衡转 化率随温度(T)、压强(P)的变化关系如图所示。该反应的H_______0(填“>”、“<”或“=”),比较A点时用CO表示的正反应速率与B点时用CH3OH表示的逆反应速率的大小v正(CO)____v逆(CH3OH)(填“>”、“<”或“=”)。若在压强P1下达到化学平衡状态A时,容器的体积为10L。如果反应开始时仍充入2molCO和4molH2,则在压强P2下达到平衡状态B时容器的体积V(B)=________L。
(3)从平衡移动的角度分析AlCl3溶液可以溶解CaCO3固体的原因是_________________
(4)常温下,测得某CaCO3的饱和溶液pH=10.0,忽略CO32-的第二步水解,计算Ksp(CaCO3)=__________(保留三位有效数字)(已知:Ka1(H2CO3)=4.4×10-7Ka2(H2CO3)=4.7×10-11)
(5)有一种可充电电池Na-Al/FeS,电池工作时Na+的物质的量保持不变,并且用含Na+的导电固体作为电解质,已知该电池的正极反应式为2Na++FeS+2e-=Na2S+Fe, 则放电时负极反应式为____________________。该电池充电时,当转移2mol电子时,阳极质量的变化量为______g。
【答案】AC < < 2 CaCO3(s) ![]() Ca2+ (aq)+ CO32-(aq),Al3+ 水解显酸性,溶液中H+与CO32-结合,促进CaCO3的溶解平衡向右移,使CaCO3溶解 6.91×10-9 2Na-2e-=2Na+ 46
Ca2+ (aq)+ CO32-(aq),Al3+ 水解显酸性,溶液中H+与CO32-结合,促进CaCO3的溶解平衡向右移,使CaCO3溶解 6.91×10-9 2Na-2e-=2Na+ 46
【解析】
(1)恒容密闭容器中,保持温度不变,
A、反应H2C2O4 (s)H2O(g)+CO(g)+CO2(g)是一个气体体积增大的反应,恒容时,容器的压强不再变化,说明该反应已达到化学平衡状态,故A正确;
B、在反应H2C2O4 (s)H2O(g)+CO(g)+CO2(g)中,CO2(g)的体积分数始终保持不变,不能说明该反应已达到化学平衡状态,故B错误;
C、密度=![]() ,气体的总质量会变,体积不变,混合气体的密度不再变化能说明该反应已达到化学平衡状态,故C正确;
,气体的总质量会变,体积不变,混合气体的密度不再变化能说明该反应已达到化学平衡状态,故C正确;
D、生成物气体是按照固定比例生成的,气体平均摩尔质量不发生变化,所以当气体平均摩尔质量不再发生变化,不能说明该反应已达到化学平衡状态,故D错误。
(2)根据图象可知,温度升高CO的平衡转化率下降,所以为放热反应,H<0;
CO(g)+2H2(g)CH3OH(g)正反应是气体体积减小的方向,当其他条件不变时,增大压强,平衡向正反应方向移动,CO的平衡转化率增大,由图可知A点CO的平衡转化率比B点CO的平衡转化率小,说明P1< P2,当其他条件不变时,压强越高,反应速率越快,则v正(CO) <v逆(CH3OH);
利用A点时CO的转化率为50%,
CO(g)+2H2(g)CH3OH(g)
起始(mol):2 4 0
转化(mol):1 2 1
平衡(mol):1 2 1
K=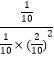 =25
=25
A、B两容器温度相同,即化学平衡常数相等,且B点时CO的转化率为0.8,
则 CO(g)+2H2(g)CH3OH(g)
起始(mol):2 4 0
转化(mol):1.6 3.2 1.6
平衡(mol):0.4 0.8 1.6
设体积为VL,则有K=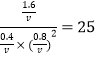 得V=2L
得V=2L
(3)CaCO3(s) ![]() Ca2+ (aq)+ CO32-(aq),Al3+ 水解显酸性,溶液中H+与CO32-结合,促进CaCO3的溶解平衡向右移,使CaCO3溶解;
Ca2+ (aq)+ CO32-(aq),Al3+ 水解显酸性,溶液中H+与CO32-结合,促进CaCO3的溶解平衡向右移,使CaCO3溶解;
(4)由Ka2(H2CO3)=4.7×10-11可知CO32-+H2OHCO3-+OH-的水解Kh=![]()
常温下,测得CaCO3与水形成的浊液pH为10,c(HCO3-)=c(OH-)=1×10-4,
可知c(CO32-)=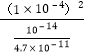 =
=![]()
又c(Ca2+)=c/span>(CO32-)+c(HCO3-)=![]()
Ksp(CaCO3)=c(Ca2+)×c(CO32-)=![]() ×
×![]() =6.91×10-9
=6.91×10-9
(5)Na性质活泼,易失去电子而被氧化,应为原电池的负极,电极方程式为2Na-2e-=2Na+;充电时,阳极发生氧化反应,电极方程式为
Na2S+Fe-2e-=2Na++FeS △m
2mol 46g
该电池充电时,当转移2mol电子时,阳极质量的变化量为46g。

【题目】乙二酸俗名草酸,易溶于水,为了测定草酸晶体H2C2O4·xH2O中的x值,某实验小组进行实验,步骤如下:
①称取1.260g草酸晶体,配成100mL溶液。
②取25.00mL该H2C2O4溶液加入锥形瓶内,再加入适量稀硫酸。
③用浓度为0.1000mol/L的KMnO4标准溶液进行滴定,至滴定达到终点。
④重复实验。记录整理数据如下:
实验序号 | V(KMnO4溶液) | |
滴定前刻度/mL | 滴定后刻度/mL | |
1 | 0.10 | 10.00 |
2 | 1.10 | 11.10 |
3 | 1.50 | 13.50 |
4 | 0.70 | 10.80 |
回答下列问题:
(1)乙二酸和KMnO4标准溶液反应的离子方程式为____________
(2)步骤①需要使用烧杯、量筒、玻璃棒、胶头滴管,还缺少的玻璃仪器为_______(填名称);步骤③滴定过程中,盛装KMnO4溶液的仪器为__________________(填名称)。
(3)本实验滴定达到终点的标志是__________________________;
(4)根据数据,计算H2C2O4溶液的物质的量浓度为______mol/L,x=____________;
(5)若滴定终点时仰视滴定管刻度,则x值会_____________(填“偏大”、“偏小”或“不变”) 。