题目内容
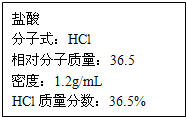 如图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题:
如图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题:(1)该浓盐酸中HCl的物质的量浓度为
12
12
mol/L.(2)取用任意体积的该盐酸溶液时,下列物理量中不随所取体积的多少而变化的是
BD
BD
.A.溶液中HCl的物质的量 B.溶液的浓度
C.溶液中Cl-的数目 D.溶液的密度
(3)某学生欲用上述浓盐酸和蒸馏水配制500mL物质的量浓度为0.3mol/L稀盐酸.
①该学生需要量取
12.5
12.5
mL上述浓盐酸进行配制.②配制过程中,需要使用的仪器是(填写代号)
ABFGH
ABFGH
.A.烧杯 B.量筒 C.1000mL容量瓶 D.托盘天平
E.药匙 F.500mL容量瓶 G.胶头滴管 H.玻璃棒
③配制时,其正确的操作顺序是(字母表示,每个字母只能用一次)
BCAFED
BCAFED
;A.用30mL水洗涤烧杯2-3次,洗涤液均注入容量瓶,振荡
B.用量筒准确量取所需浓盐酸的体积,慢慢沿杯壁注入盛有少量水(约30mL)的烧杯中,用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的盐酸沿玻璃棒注入500mL的容量瓶中
D.将容量瓶盖紧,颠倒摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度线相切
F.继续往容量瓶内小心加水,直到液面接近刻度线1-2cm处
④在配制过程中,下列实验操作会使所配制的稀盐酸的物质的量浓度偏高的是
BCD
BCD
A.用量筒量取浓盐酸时俯视观察凹液面
B.溶液注入容量瓶前没有恢复到室温就进行定容
C.定容时仰视刻度线
D.在配置前用已知浓度的稀盐酸润洗容量瓶
(4)若在标准状况下,将VLHCl气体溶于1L水中,所得溶液密度为d g/mL,则此溶液的物质的量浓度为
| 1000Vd |
| 22400+36.5V |
| 1000Vd |
| 22400+36.5V |
(5)现将100mL0.5mol/L的盐酸200mL0.1mol/LCuCl2溶液混合,体积变化忽略不计,所得溶液中Cl-的物质的量浓度是
0.3mol/L
0.3mol/L
.分析:(1)根据c=
计算;
(2)溶液为均一稳定分散系,浓度、密度不变;
(3)①根据溶液稀释前后溶质的物质的量不变计算所需盐酸的体积;
②根据溶液的配制步骤选择所使用的仪器;
③操作步骤有计算、称量、溶解、移液、洗涤移液、定容、摇匀等操作,以此判断;
④根据c=
分析操作对溶质的物质的量或对溶液的体积的影响判断;
(4)分别计算溶质的物质的量、质量,进而计算溶液的质量,求得溶液的体积,根据c=
计算浓度;
(5)根据质量守恒计算氯离子的总物质的量,进而计算浓度.
| 1000ρw |
| M |
(2)溶液为均一稳定分散系,浓度、密度不变;
(3)①根据溶液稀释前后溶质的物质的量不变计算所需盐酸的体积;
②根据溶液的配制步骤选择所使用的仪器;
③操作步骤有计算、称量、溶解、移液、洗涤移液、定容、摇匀等操作,以此判断;
④根据c=
| n |
| V |
(4)分别计算溶质的物质的量、质量,进而计算溶液的质量,求得溶液的体积,根据c=
| n |
| V |
(5)根据质量守恒计算氯离子的总物质的量,进而计算浓度.
解答:解:(1)c=
=
=12mol/L,故答案为:12mol/L;
(2)溶液为均一稳定分散系,浓度、密度不变,而体积不同时,溶质的物质的量和离子数目变化,故答案为:BD;
(3)①设需要浓盐酸的体积为V,0.3mol/L×0.5L=12mol/L×V,V=0.0125L=12.5mL,故答案为:12.5;
②操作步骤有计算、量取、溶解、移液、洗涤移液、定容、摇匀等操作,一般用量筒,在烧杯中溶解(可用量筒量取水加入烧杯),并用玻璃棒搅拌,加速溶解.冷却后转移到500mL容量瓶中,并用玻璃棒引流,洗涤烧杯、玻璃棒2-3次,并将洗涤液移入容量瓶中,加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,最后定容颠倒摇匀.所以所需仪器有量筒、烧杯、玻璃棒、500mL容量瓶、胶头滴管,故答案为:ABFGH;
③操作步骤有计算、量取、稀释、移液、洗涤移液、定容、摇匀等操作,用量筒(用到胶头滴管)准确量取所需浓盐酸的体积,在烧杯中稀释,用玻璃棒搅拌,恢复室温后转移到500mL容量瓶中,并用玻璃棒引流,洗涤2-3次,将洗涤液转移到容量瓶中,加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,最后定容颠倒摇匀,
故答案为:BCAFED;
④A.用量筒量取浓盐酸时俯视观察凹液面,会导致量取液体的体积偏小,所配溶液浓度偏小,故A不选;
B.溶液注入容量瓶前没有恢复到室温就进行定容,会溶液的体积偏小,溶液浓度偏大,故B选;
C.定容时仰视刻度线,会溶液的体积偏小,溶液浓度偏大,故C选;
D.在配置前用已知浓度的稀盐酸润洗容量瓶,会导致溶质的物质的量偏大,溶液浓度偏大,故D选.
故答案为:BCD;
(4)n(HCl)=
mol,m(HCl)=
mol×36.5g/mol=
g,
m(溶液)=m(HCl)+m(水)=
g+1000g,
V(溶液)=
=
×10-3L,
c(HCl)=
=
mol/L,
故答案为:
;
(5)n(Cl-)=0.1L×0.5mol/L+2×0.2L×0.1mol/L=0.09mol.
V=100mL+200ml=300ml=0.3L,
c(Cl-)=
=0.3mol/L,
故答案为:0.3mol/L.
| 1000ρw |
| M |
| 1000×1.2g/L×36.5% |
| 36.5g/mol |
(2)溶液为均一稳定分散系,浓度、密度不变,而体积不同时,溶质的物质的量和离子数目变化,故答案为:BD;
(3)①设需要浓盐酸的体积为V,0.3mol/L×0.5L=12mol/L×V,V=0.0125L=12.5mL,故答案为:12.5;
②操作步骤有计算、量取、溶解、移液、洗涤移液、定容、摇匀等操作,一般用量筒,在烧杯中溶解(可用量筒量取水加入烧杯),并用玻璃棒搅拌,加速溶解.冷却后转移到500mL容量瓶中,并用玻璃棒引流,洗涤烧杯、玻璃棒2-3次,并将洗涤液移入容量瓶中,加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,最后定容颠倒摇匀.所以所需仪器有量筒、烧杯、玻璃棒、500mL容量瓶、胶头滴管,故答案为:ABFGH;
③操作步骤有计算、量取、稀释、移液、洗涤移液、定容、摇匀等操作,用量筒(用到胶头滴管)准确量取所需浓盐酸的体积,在烧杯中稀释,用玻璃棒搅拌,恢复室温后转移到500mL容量瓶中,并用玻璃棒引流,洗涤2-3次,将洗涤液转移到容量瓶中,加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,最后定容颠倒摇匀,
故答案为:BCAFED;
④A.用量筒量取浓盐酸时俯视观察凹液面,会导致量取液体的体积偏小,所配溶液浓度偏小,故A不选;
B.溶液注入容量瓶前没有恢复到室温就进行定容,会溶液的体积偏小,溶液浓度偏大,故B选;
C.定容时仰视刻度线,会溶液的体积偏小,溶液浓度偏大,故C选;
D.在配置前用已知浓度的稀盐酸润洗容量瓶,会导致溶质的物质的量偏大,溶液浓度偏大,故D选.
故答案为:BCD;
(4)n(HCl)=
| V |
| 22.4 |
| V |
| 22.4 |
| 36.5V |
| 22.4 |
m(溶液)=m(HCl)+m(水)=
| 36.5V |
| 22.4 |
V(溶液)=
| ||
| dg/mL |
| 36.5V+22400 |
| 22.4d |
c(HCl)=
| ||
|
| 1000Vd |
| 22400+36.5V |
故答案为:
| 1000Vd |
| 22400+36.5V |
(5)n(Cl-)=0.1L×0.5mol/L+2×0.2L×0.1mol/L=0.09mol.
V=100mL+200ml=300ml=0.3L,
c(Cl-)=
| 0.09mol |
| 0.3L |
故答案为:0.3mol/L.
点评:本题考查较为综合,设计溶液的配制、使用仪器、操作步骤、误差分析以及溶液浓度的计算,题目难度中等,做好本题,一是需要有夯实的基础知识,二是把握物质的量浓度的计算方法.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
 如图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题:
如图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题: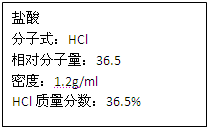 如图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题:
如图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题:
 如图为实验室某浓盐酸试剂瓶的标签上的有关数据,试回答下列问题:
如图为实验室某浓盐酸试剂瓶的标签上的有关数据,试回答下列问题: 如图为实验室某浓盐酸试剂瓶上的标签的有关内容,试根据标签上的有关数据回答下列问题:
如图为实验室某浓盐酸试剂瓶上的标签的有关内容,试根据标签上的有关数据回答下列问题: