题目内容
【题目】I.已知,常温下H2S、H2CO3的电离常数如表
Ka1 | Ka2 | |
H2S | 9.1×10-8 | 1×10-15 |
H2CO3 | 4.3×10-7 | 5.6×10-11 |
(1)①常温下,0.1 mol·L-1的硫化钠溶液和0.1mol·L-1的碳酸钠溶液,碱性更强的是_______。其原因是_____________________________。
②常温下,硫化钠水解的离子方程式为_____________________________。
(2)常温下,向100mL0.1mol·L-1H2S溶液中滴加0.1mol·L-1NaOH溶液,得到溶液pH与NaOH溶液体积的关系曲线如图所示:

试分析图中a、b、c、d四个点,水的电离程度最大的是________。
II.减少NO2、SO2、CO等有害气体对大气环境的危害,是人类的共同追求。
(3)以甲醇做燃料的电池,如图所示,其负极反应式为________,该燃料电池在理想状态下,将有96.5%的化学能转化成电能,即消耗1mol液体甲醇所能产生的最大电能达702.1kJ,则通常甲醇燃烧的热化学反应方程式为________。

(4)已知:NO2(g)+SO2(g)![]() SO3(g)+NO(g) △H=+41.8kJmol﹣1。一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的________。
SO3(g)+NO(g) △H=+41.8kJmol﹣1。一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的________。
a.体系压强保持不变 b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变 d.每消耗1molSO3的同时生成1molNO2
(5)当上述反应平衡时,测得NO2与SO2体积比为1:6,则平衡常数K=________。
【答案】硫化钠溶液 硫化氢的Ka2小于碳酸的Ka2,硫化钠更易水解 S2-+H2O![]() HS-+OH(主)、HS-+H2O
HS-+OH(主)、HS-+H2O![]() H2S+OH-(次) c CH3OH﹣6e-+H2O=CO2↑+6H+ CH3OH(l)+
H2S+OH-(次) c CH3OH﹣6e-+H2O=CO2↑+6H+ CH3OH(l)+![]() O2(g)=CO2(g)+2H2O(l)△H=﹣727.6kJ/mol b
O2(g)=CO2(g)+2H2O(l)△H=﹣727.6kJ/mol b ![]()
【解析】
(1)①H2S的Ka2=1×10-15,而H2CO3的Ka2=5.6×10-11,则H2S的第二步电离程度小,S2-的水解程度大,碱性更强的是硫化钠溶液。其原因是硫化氢的Ka2小于碳酸的Ka2,硫化钠更易水解。答案为:硫化钠溶液;硫化氢的Ka2小于碳酸的Ka2,硫化钠更易水解;
②H2S为弱酸,电离分步进行,则硫化钠水解也分步进行,离子方程式为S2-+H2O![]() HS-+OH(主)、HS-+H2O
HS-+OH(主)、HS-+H2O![]() H2S+OH-(次)。答案为:S2-+H2O
H2S+OH-(次)。答案为:S2-+H2O![]() HS-+OH(主)、HS-+H2O
HS-+OH(主)、HS-+H2O![]() H2S+OH-(次);
H2S+OH-(次);
(2) S2-的水解程度大于HS-,对水电离的促进作用也是S2-大于HS-,H2S与NaOH完全反应生成Na2S的点,就是水电离程度最大的点。从图中可以看出,c点应是完全反应生成Na2S的点,所以水的电离程度最大的是c。答案为:c;
(3)从图中可以看出,a电极通入O2为正极,则b电极为负极。在负极,CH3OH失电子的产物与酸性电解质反应生成CO2等,负极反应式为CH3OH﹣6e-+H2O=CO2↑+6H+,该燃料电池中,1mol甲醇燃烧理论上放热![]() kJ=727.6kJ,热化学反应方程式为CH3OH(l)+
kJ=727.6kJ,热化学反应方程式为CH3OH(l)+![]() O2(g)=CO2(g)+2H2O(l) △H=﹣727.6kJ/mol。答案为:CH3OH﹣6e-+H2O=CO2↑+6H+;CH3OH(l)+
O2(g)=CO2(g)+2H2O(l) △H=﹣727.6kJ/mol。答案为:CH3OH﹣6e-+H2O=CO2↑+6H+;CH3OH(l)+![]() O2(g)=CO2(g)+2H2O(l) △H=﹣727.6kJ/mol;
O2(g)=CO2(g)+2H2O(l) △H=﹣727.6kJ/mol;
(4) a.因为反应前后气体的分子数相等,体系压强保持不变,所以压强不变时,反应不一定达平衡状态,a不合题意;
b.混合气体颜色保持不变,表明c(NO2)不变,则反应达平衡状态,b符合题意;
c.由反应方程式知,SO3和NO的体积比始终保持不变,所以体积比不变时,反应不一定达平衡状态,c不合题意;
d.每消耗1molSO3的同时生成1molNO2,反应进行的方向相同,反应不一定达平衡状态,d不合题意;
故选b。答案为:b;
(5)令起始时c(NO2)=1mol/L,则c(SO2)=2mol/L,设c(NO2)=x mol/L,则三段式为:
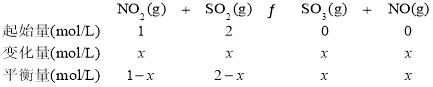
依题意,![]() ,x=0.8,K=
,x=0.8,K=![]() =
=![]() 。答案为:
。答案为:![]() 。
。