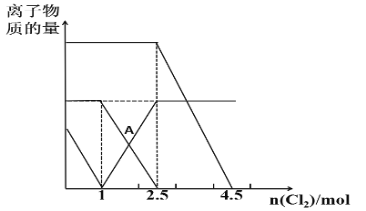
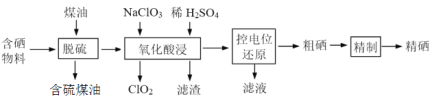
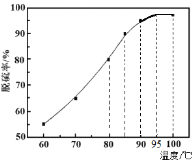
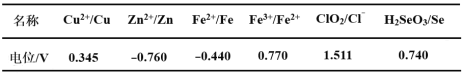题目内容
【题目】2SO2(g)+O2(g)2SO3(g)反应过程的能量变化如图所示,已知1mol SO2(g)被氧化为1mol SO3(g)的ΔH= -99kJ·mol-1。回答下列问题:
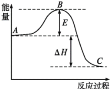
(1)图中A、C分别表示:________、________。
(2)图中ΔH=___kJ·mol-1。
(3)已知单质硫的燃烧热为296kJ·mol-1,计算由S(s)生成3mol SO3(g)的ΔH 并写出其热化学反应方程式:________。
【答案】反应物能量 生成物能量 -198 S(s)+O2(g)=SO2(g) ΔH1=-296kJ·mol-1,SO2(g)+![]() O2(g)=SO3(g) ΔH2=-99kJ·mol-1,3S(s)+
O2(g)=SO3(g) ΔH2=-99kJ·mol-1,3S(s)+![]() O2(g)=3SO3(g) ΔH= -1185kJ·mol-1
O2(g)=3SO3(g) ΔH= -1185kJ·mol-1
【解析】
(1)根据A、C分别表示反应物总能量和生成物总能量;
(2)根据参加反应SO2的物质的量之比等于对应的△H之比;
(3)根据单质硫的燃烧热以及1mol SO2(g)氧化为1mol SO3(g)的反应热利用盖斯定律来求;
(1)图中A、C分别表示反应物总能量、生成物总能量;
(2)因1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJmol-1,所以2mol SO2(g)氧化为2mol SO3(g)的△H=-198kJmol-1,则2SO2(g)+O2(g)=2SO3(g)△H=-198kJmol-1;
(3)因单质硫的燃烧热为296kJmol-1,则S(s)+O2(g)=SO2(g) ΔH1=-296kJmol-1,而 1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJmol-1,则SO2(g)+![]() O2(g)=SO3(g) ΔH2=-99kJmol-1,由盖斯定律可得:S(s)+
O2(g)=SO3(g) ΔH2=-99kJmol-1,由盖斯定律可得:S(s)+![]() O2(g)=SO3(g)△H=-296kJmol-1+(-99kJmol-1)=-395kJmol-1,所以S(s)生成3mol SO3(g)的△H为-395kJmol-1×3=-1185 kJmol-1,其热化学反应方程式:3S(s)+
O2(g)=SO3(g)△H=-296kJmol-1+(-99kJmol-1)=-395kJmol-1,所以S(s)生成3mol SO3(g)的△H为-395kJmol-1×3=-1185 kJmol-1,其热化学反应方程式:3S(s)+![]() O2(g) = 3SO3(g) ΔH= -1185 kJ·mol-1。
O2(g) = 3SO3(g) ΔH= -1185 kJ·mol-1。

【题目】I.已知,常温下H2S、H2CO3的电离常数如表
Ka1 | Ka2 | |
H2S | 9.1×10-8 | 1×10-15 |
H2CO3 | 4.3×10-7 | 5.6×10-11 |
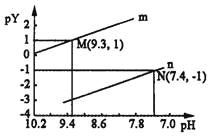
(1)①常温下,0.1 mol·L-1的硫化钠溶液和0.1mol·L-1的碳酸钠溶液,碱性更强的是_______。其原因是_____________________________。
②常温下,硫化钠水解的离子方程式为_____________________________。
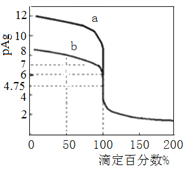
(2)常温下,向100mL0.1mol·L-1H2S溶液中滴加0.1mol·L-1NaOH溶液,得到溶液pH与NaOH溶液体积的关系曲线如图所示:
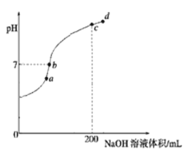
试分析图中a、b、c、d四个点,水的电离程度最大的是________。
II.减少NO2、SO2、CO等有害气体对大气环境的危害,是人类的共同追求。
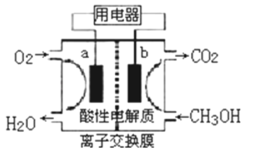
(3)以甲醇做燃料的电池,如图所示,其负极反应式为________,该燃料电池在理想状态下,将有96.5%的化学能转化成电能,即消耗1mol液体甲醇所能产生的最大电能达702.1kJ,则通常甲醇燃烧的热化学反应方程式为________。
(4)已知:NO2(g)+SO2(g)![]() SO3(g)+NO(g) △H=+41.8kJmol﹣1。一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的________。
SO3(g)+NO(g) △H=+41.8kJmol﹣1。一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的________。
a.体系压强保持不变 b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变 d.每消耗1molSO3的同时生成1molNO2
(5)当上述反应平衡时,测得NO2与SO2体积比为1:6,则平衡常数K=________。