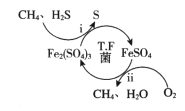
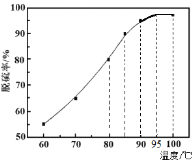
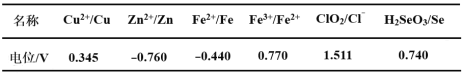题目内容
【题目】医学上在进行胃肠疾病的检查时,利用X射线对BaSO4穿透能力较差的特性,常用BaSO4做内服造影剂,这种检查手段称为钡餐透视。
(1)用离子方程式说明钡餐透视时为什么不用BaCO3?____________________________________________。
(2)某课外活动小组为探究BaSO4的溶解度,分别将足量BaSO4放入:① 5 mL水② 20 mL 0.5 mol·L-1的Na2SO4溶液③ 40 mL 0.2mol·L-1的Ba(OH)2溶液④ 40 mL 0.1 mol·L-1的H2SO4溶液中,溶解至饱和以上各溶液中,c(Ba2+)的大小顺序正确的是________,BaSO4的溶解度的大小顺序为______________
A.③ >① >④ >② B.③ >① >② >④ C.① >④ >③ >② D.① >③ >④ >②
(3)已知25℃时,Ksp(BaSO4)=1.1×10-10,上述条件下,溶液③中的c(SO42-)为 ______________,溶液②中c(Ba2+)为 __________________。
(4)取溶液③和溶液④直接混合,则混合溶液的pH为 __________ (假设混合后溶液的体积为混合前两溶液的体积之和)。
【答案】BaCO3+2H+=Ba2++H2O+CO2 ↑ A C 5.5×10-10mol·L-1 2.2×10-10mol·L-1 13
【解析】
(1)硫酸钡不溶于水和酸,但胃酸可与CO32反应生成水和二氧化碳,使CO32浓度降低,从而使平衡BaCO3(s) Ba2+(aq)+CO32 (aq) 向溶解方向移动,使Ba2+浓度增大,且Ba2+有毒,所以不能用碳酸钡代替硫酸钡,反应离子方程式为:BaCO3+2H+═Ba2++H2O+CO2↑,
故答案为:BaCO3+2H+=Ba2++H2O+CO2 ↑
(2) BaSO4在溶液中存在溶解平衡,BaSO4 (s) Ba2+(aq)+ SO42 (aq),根据难溶电解质的溶度积常数知,溶液中硫酸根离子浓度越大,溶解平衡向生成沉淀的方向移动,硫酸钡的溶解度越小,钡离子浓度越低;氢氧化钡能抑制硫酸钡的电离,但氢氧化钡溶液中含有钡离子,所以钡离子浓度最大;水中的钡离子浓度次之;硫酸钠溶液和硫酸溶液中都含有硫酸根离子,抑制硫酸钡的电离,硫酸钠中的硫酸根浓度大于硫酸中的硫酸根浓度,所以硫酸钠溶液抑制硫酸钡电离作用更强,硫酸钠溶液中钡离子的浓度小于硫酸溶液中钡离子浓度,所以钡离子浓度大小顺序是:③>①>④>②;硫酸钡溶液中加入硫酸根离子和钡离子都会导致硫酸钡的沉淀溶解平衡逆移,硫酸钡的溶解度减小,①加入 5 mL水是硫酸根离子和钡离子浓度减小,使硫酸钡的溶解平衡向沉淀溶解的方向移动,硫酸钡的溶解度增大;②③④都使硫酸根离子或钡离子浓度增大,抑制了硫酸钡的溶解②中硫酸根离子浓度为0.5 mol·L-1,③中钡离子浓度为0.2mol·L-1④中硫酸根离子浓度0.1 mol·L-1,,硫酸根离子或钡离子浓度越大,硫酸钡的溶解度越小,所以BaSO4的溶解度的大小顺序:①>④>③>②,
故答案为:A;C;
(3)已知25℃时,Ksp(BaSO4)=1.1×1010,上述条件下,溶液③中的c(SO42)=![]() =
=![]() =5.5×1010mol/L,溶液②中c(Ba2+)=
=5.5×1010mol/L,溶液②中c(Ba2+)=![]() =
=![]() mol/L=2.2×1010mol/L,
mol/L=2.2×1010mol/L,
故答案为:5.5×1010mol/L;2.2×1010mol/L;
(3)40mL 0.2molL1的Ba(OH)2溶液和40mL 0.1molL1的H2SO4溶液中混合后溶液中c(OH)=![]() =0.1mol/L,则c(H+)=
=0.1mol/L,则c(H+)=![]() =
=![]() =1013 mol/L,所以pH=13,
=1013 mol/L,所以pH=13,
故答案为:13。

【题目】I.已知,常温下H2S、H2CO3的电离常数如表
Ka1 | Ka2 | |
H2S | 9.1×10-8 | 1×10-15 |
H2CO3 | 4.3×10-7 | 5.6×10-11 |
(1)①常温下,0.1 mol·L-1的硫化钠溶液和0.1mol·L-1的碳酸钠溶液,碱性更强的是_______。其原因是_____________________________。
②常温下,硫化钠水解的离子方程式为_____________________________。
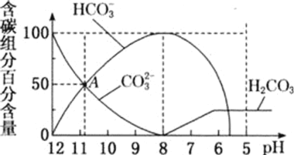
(2)常温下,向100mL0.1mol·L-1H2S溶液中滴加0.1mol·L-1NaOH溶液,得到溶液pH与NaOH溶液体积的关系曲线如图所示:
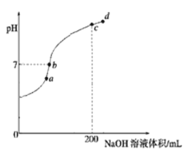
试分析图中a、b、c、d四个点,水的电离程度最大的是________。
II.减少NO2、SO2、CO等有害气体对大气环境的危害,是人类的共同追求。
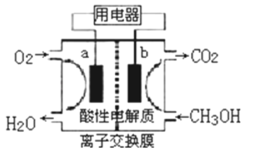
(3)以甲醇做燃料的电池,如图所示,其负极反应式为________,该燃料电池在理想状态下,将有96.5%的化学能转化成电能,即消耗1mol液体甲醇所能产生的最大电能达702.1kJ,则通常甲醇燃烧的热化学反应方程式为________。
(4)已知:NO2(g)+SO2(g)![]() SO3(g)+NO(g) △H=+41.8kJmol﹣1。一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的________。
SO3(g)+NO(g) △H=+41.8kJmol﹣1。一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的________。
a.体系压强保持不变 b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变 d.每消耗1molSO3的同时生成1molNO2
(5)当上述反应平衡时,测得NO2与SO2体积比为1:6,则平衡常数K=________。
【题目】在一定体积的密闭容器中,进行如下化学反应:
CO2(g)+H2(g)![]() CO(g)+H2O(g),
CO(g)+H2O(g),
其化学平衡常数K和温度t的关系如下表:
t℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K=_____________。
(2)该反应为______反应(选填吸热、放热)。
升高温度CO2的转化将____________(填增大、减小或不变)。
(3)能判断该反应是否达到化学平衡状态的依据是______(多选扣分)。
a.容器中压强不变 b.混合气体中 c(CO)不变
c.v正(H2)=v逆(H2O) d.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式: c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为______℃。