题目内容
a、b、c、d、e、f、g、h为8种由短周期元素构成的微粒,它们都有10个电子,其结构特点如下:
| 微粒代码 | a | b | c | d | e | f | g | h |
| 原子核个数 | 单核 | 单核 | 双核 | 多核 | 单核 | 多核 | 多核 | 多核 |
| 带电荷数(单位:电荷) | 0 | +1 | -1 | 0 | +2 | +1 | 0 | +1 |
(1)a微粒原子核外结构示意图:___________,该元素属于周期表中的_____区。
c微粒电子式为 ___________。?
(2)b与e相应元素的最高价氧化物对应水化物的碱性强弱比较为:
________>___________(写化学式)?
(3)c微粒和f微粒反应生成2分子g的离子方程式为_____________________。?
(4)大量c微粒和大量h微粒共热生成d微粒的离子反应方程式为______________。?
(5)微粒g中心原子杂化方式为_______ ;d微粒分子结构呈__________型;
(16分)(1)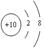 ;p ;
;p ;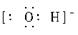 (2) NaOH;Mg(OH)2?
(2) NaOH;Mg(OH)2?
(3) H3O++ OH-=2H2O?(4)NH4++OH-=NH3↑+H2O?(5) sp3 、三角锥形
解析试题分析:(1)a是单核10电子微粒,所以a是Ne,其原子核外结构示意图是 。区的名称来自于按照构造原理最后填入电子的轨道名称,所以该元素属于周期表中的p区。C是双核带1个负电荷,因此c是OH-,其电子式为
。区的名称来自于按照构造原理最后填入电子的轨道名称,所以该元素属于周期表中的p区。C是双核带1个负电荷,因此c是OH-,其电子式为 。
。
(2)b与e分别是单核带1个正电荷和2个正电荷,则分别是和钠离子和镁离子键,钠的金属性强于镁的金属性,所以相应元素的最高价氧化物对应水化物的碱性强弱比较为NaOH>Mg(OH)2。
(3)f是多核带1个正电荷,且c微粒和f微粒反应生成2分子g,所以所以f是H3O+,该反应的离子方程式为H3O++ OH-=2H2O。
(4) h是多核带1个正电荷,则h是NH4+。所以大量c微粒和大量h微粒共热生成d微粒的离子反应方程式为NH4++OH-=NH3↑+H2O。
(5)微粒g是水,空间构型是V形结构,所以中心原子杂化方式为sp3;氨气分子结构呈三角锥型。
考点:考查10电子微粒、化学式、电子式、原子结构示意图、方程式、空间构型以及杂化轨道类型的有关判断
点评:该题是中等难度的试题,试题基础性强,侧重对学生能力的培养和解题方法的指导与训练。该题的关键是熟练记住常见的10电子微粒,然后结合题意灵活运用即可,有利于培养学生的逻辑推理和抽象思维能力,提高学生的应试能力和学习效率。

练习册系列答案
相关题目
 [化学/选修/物质结构与性质]A、B、C、D、E五种短周期元素,原子序数依次增大,各元素对应的单质均为固体.A、C、E三元素的原子核外均只有2个未成对电子.B、E元素的原子序数之和等于C、D元素的原子序数之和.
[化学/选修/物质结构与性质]A、B、C、D、E五种短周期元素,原子序数依次增大,各元素对应的单质均为固体.A、C、E三元素的原子核外均只有2个未成对电子.B、E元素的原子序数之和等于C、D元素的原子序数之和.