题目内容
【题目】如图所示,甲池的总反应式为N2H4+O2===N2+2H2O。下列说法正确的是( )
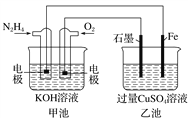
A. 甲池中负极上的电极反应式为N2H4-4e-===N2+4H+
B. 乙池中石墨电极上发生的反应为4OH--4e-===2H2O+O2↑
C. 甲池溶液pH增大,乙池溶液pH减小
D. 甲池中每消耗0.1 mol N2H4乙池电极上则会析出6.4 g固体
【答案】B
【解析】A项,甲池为原电池,由总反应式可得,通N2H4的电极为负极,发生失电子氧化反应生成N2,电解质溶液为KOH溶液,所以负极上的电极反应式为:N2H4+4OH--4e-=N2+4H2O,故A错误;B项,乙池为电解池,石墨电极为阳极,发生失电子氧化反应,电解质溶液为硫酸铜溶液,所以石墨电极上发生的反应为2H2O-4e-=4H++O2↑,故B正确;C项,乙池总反应为:2CuSO4+2H2O![]() 2Cu+2H2SO4+O2↑,因生成硫酸,所以酸性增强,pH减小,由甲池总反应N2H4+O2=N2+2H2O可得,若忽略生成的水造成的溶液体积增大,则碱性不变,pH不变,若考虑生成的水造成的溶液体积增大,则碱性减弱,pH减小,故C错误;D项,由N2H4+4OH--4e-=N2+4H2O得,甲池中每消耗0.1molN2H4失去0.4mol电子,乙池析出Cu的反应为:Cu2++2e-=Cu,串联电路中根据得失电子守恒可得,生成0.2molCu,质量为12.8g,故D错误。
2Cu+2H2SO4+O2↑,因生成硫酸,所以酸性增强,pH减小,由甲池总反应N2H4+O2=N2+2H2O可得,若忽略生成的水造成的溶液体积增大,则碱性不变,pH不变,若考虑生成的水造成的溶液体积增大,则碱性减弱,pH减小,故C错误;D项,由N2H4+4OH--4e-=N2+4H2O得,甲池中每消耗0.1molN2H4失去0.4mol电子,乙池析出Cu的反应为:Cu2++2e-=Cu,串联电路中根据得失电子守恒可得,生成0.2molCu,质量为12.8g,故D错误。

练习册系列答案
 同步拓展阅读系列答案
同步拓展阅读系列答案
相关题目