题目内容
【题目】甲醇既可用于基本有机原料,又可作为燃料用于替代矿物燃料。
(1)以下是工业上合成甲醇的反应:![]()
![]() 下表所列数据是该反应在不同温度下的化学平衡常数
下表所列数据是该反应在不同温度下的化学平衡常数![]() .
.
温度 | 250℃ | 300℃ | 350℃ |
K | 2.041 | 0.270 | 0.012 |
由表中数据判断反应I为 ______ 热反应(填“吸”或“放”) ![]() 某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应,达到平衡后,测得
某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应,达到平衡后,测得![]() ,则CO的转化率为 ______ ,此时的温度为 ______ 从表中选择.
,则CO的转化率为 ______ ,此时的温度为 ______ 从表中选择.
(2)已知在常温常压下:
①![]()
②![]()
③![]()
则反应![]() ______
______ ![]() 用
用![]() 、
、![]() 、
、![]() 表示
表示
(3)处理废水时,最后![]() 以
以![]() 形式除去,当
形式除去,当![]() 时,
时,![]() 沉淀完全,此时溶液的
沉淀完全,此时溶液的![]() ______ (已知,
______ (已知,![]() ,
,![]() )
)
【答案】放 ![]()
![]()
![]()
![]() 5.6
5.6
【解析】
(1)由表中数据可知,随温度升高平衡常数减小,说明升高温度平衡逆向移动,则正反应为放热反应;某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)=0.2mol/L,根据三段式列式计算平衡常数,进而判断温度;
(2)根据盖斯定律分析解答;
(3)Ksp=c(Cr3+)×c3(OH-)=6.4×1031计算c(OH-),根据Kw=c(H+)×(OH-)计算溶液中c(H+),再根据pH=-lgc(H+)计算。
(1)由表中数据可知,随温度升高平衡常数减小,说明升高温度平衡逆向移动,则正反应为放热反应,故△H<0,某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)=0.2mol/L,则:

CO转化率=![]() ×100%=80%,平衡常数K=
×100%=80%,平衡常数K=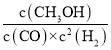 =
=![]() =2.041,故温度为250℃,故答案为:放;80%;250℃;
=2.041,故温度为250℃,故答案为:放;80%;250℃;
(2)①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) △H1 kJ/mol,②2CO(g)+O2(g)=2CO2(g) △H2 kJ/mol,③H2O(g)=H2O(l) △H3 kJ/mol,根据盖斯定律:![]() (①-②+4③)可得:CH3OH(l)+O2(g)=CO(g)+2H2O(l) △H=
(①-②+4③)可得:CH3OH(l)+O2(g)=CO(g)+2H2O(l) △H=![]() kJ/mol,故答案为:
kJ/mol,故答案为:![]() ;
;
(3)Ksp=c(Cr3+)×c3(OH-)=6.4×1031,c(Cr3+)=1×105molL-1 时,溶液中c(OH-)=4×109molL-1,则c(H+)=![]() mol/L=2.5×106molL-1,则pH=-lg2.5×106=5.6,故答案为:5.6。
mol/L=2.5×106molL-1,则pH=-lg2.5×106=5.6,故答案为:5.6。

【题目】下列实验事实得出的相应结论不正确的是
选项 | 事实 | 结论 |
A | 其他条件相同,Na2S2O3溶液和H2SO4溶液反应,升高溶液的温度,析出硫沉淀所需时间缩短 | 当其他条件不变时,升高反应温度,化学反应速率加快 |
B | 向2.0 mL浓度均为0.1 mol·L-1的KCl、KI混合溶液中滴加1~2滴0.01 mol·L-1AgNO3溶液,振荡,沉淀呈黄色 | Ksp:AgCl>AgI |
C | 2NO2(g) | 加压平衡向着气体颜色加深的方向移动 |
D | 将MgCl2溶液蒸干后灼烧,得到MgO固体 | 蒸干的过程中水解生成的HCl挥发,水解进一步促进生成Mg(OH)2,灼烧后产生MgO |
A. A B. B C. C D. D