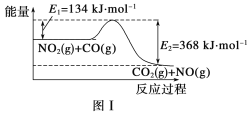
题目内容
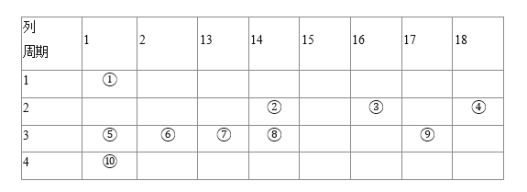
【题目】下表是元素周期表的一部分,针对表中①到⑩10种元素,填写下表空白:
(1)在最高价氧化物对应的水化物中,酸性最强的化合物的化学式是______,碱性最强的化合物的化学式是______。![]() 均填化学式
均填化学式![]()
(2)最高价氧化物对应的水化物是两性的元素是______![]() 填元素符号
填元素符号![]() ,写出它的氢氧化物与⑤的氢氧化物反应的离子方程式______。
,写出它的氢氧化物与⑤的氢氧化物反应的离子方程式______。
(3)③⑤⑥三元素形成的简单离子具有相同的电子层结构,它们的离子半径由大到小顺序是![]() 用离子符号表示
用离子符号表示![]() ______。
______。
【答案】![]() KOH Al
KOH Al ![]()
![]()
【解析】
根据元素在周期表中的位置知,①②③④⑤⑥⑦⑧⑨分别是H、C、O、Ne、Na、Mg、Al、Si、Cl、K元素,据此解答。
(1)元素非金属性越强,其最高价氧化物对应的水化物酸性最强,同一周期元素,元素的非金属性能随着原子序数的增大而呈增大,同一主族,从上到下,非金属性依次减弱,故酸性最强的化合物为HClO4;碱性最强的为KOH;
(2)最高价氧化物对应的水化物是两性的为Al(OH)3,则该元素为Al;氢氧化铝能和强碱反应生成可溶性盐,反应方程式为:![]() ;
;
(3)电子层结构相同的离子中,离子半径随着原子序数的增大而减小,核电荷数越大,对核外电子的吸引能力越强,半径越小,所以其离子半径大小顺序是:![]() 。
。

练习册系列答案
相关题目
【题目】下列有关事实及原因的分析中,错误的是![]()
![]()
事实 | 原因 | |
A. | 分子内不同化学键之间存在键角 | 共价键具有方向性 |
B. |
|
|
C. | 不含金属元素的化合物均是共价化合物 | 非金属元素间不能形成离子键 |
D. |
|
|
A.AB.BC.CD.D