题目内容
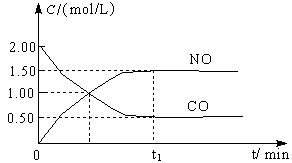
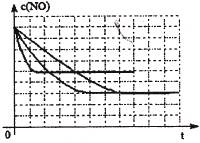
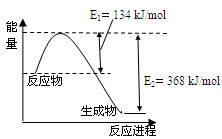
图a是1 mol NO2和1 mol CO反应生成CO2和NO过程中能量变化示意图,图b是反应中的CO和NO的浓度随时间变化的示意图。根据图意回答下列问题: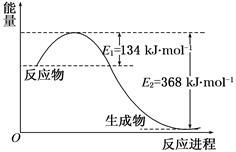
a b
(1)写出NO2和CO反应的热化学方程式 。
(2)从反应开始到平衡,用NO2浓度变化表示平均反应速率v(NO2)= 。
(3)此温度下该反应的平衡常数K= ;温度降低,K (填“变大”、“变小”或“不变”)
(4)若在温度和容积相同的三个密闭容器中,按不同方式投入反应物,测得反应达到平衡吋的有关数据如下表:
| 容 器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 1 mol NO2 1 mol CO | 2 mol NO 2 mol CO2 | 1 mol NO2、1 mol CO 1 mol NO、1 mol CO2 |
| 平衡时c(NO) /mol·L-1 | 1.5 | 3 | m |
| 能量变化 | 放出a kJ | 吸收b kJ | 放出c kJ |
| CO或NO的转化率 | α1 | α2 | α3 |
则:α1+α2= , a+b/2= ,m=
(14分)(每空2分)
(1)NO2(g)+CO(g)=NO(g)+CO2(g) ΔH=" —234" kJ/mol
(2)1.50/t1 mol·L-1·min-1
(3) 9 ; 变大
(4) 1 ; 234 ; 3
解析试题分析:(1)该反应的焓变△H=E1-E2=134KJ·mol-1-368KJ·mol-1=-234KJ·mol-1,所以热化学方程式为:NO2(g)+CO(g)=CO2(g)+NO(g)△H=-234kJ·mol-1,
故答案为:NO2(g)+CO(g)=CO2(g)+NO(g)△H=-234kJ·mol-1
(2)由图可知,t1min到达平衡,平衡时NO的浓度变化量为1.5mol·L-1,故v(NO)=1.5mol·L-1/t1min=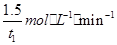 ,速率之比等于化学计量数之比,故v(NO2)=v(NO)=
,速率之比等于化学计量数之比,故v(NO2)=v(NO)=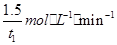
故答案为: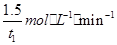
(3)CO的起始浓度为2mol·L-1,二氧化氮与NO的起始物质的量相等,故NO2的起始浓度为2mol·L-1,平衡时NO的浓度变化量为1.5mol·L-1,则:
NO2(g)+CO(g)=CO2(g)+NO(g)
开始(mol·L-1):2 2 0 0
变化(mol·L-1):1.5 1.5 1.5 1.5
平衡(mol·L-1):0.5 0.5 1.5 1.5
故该温度下平衡常数k=
该反应正反应是放热反应,降低温度平衡向正反应方向移动,平衡常数变大,
故答案为:9:变大;
(4)甲与乙是等效平衡,对应各组分的含量完全相同,对应各组分的物质的量乙是甲中的2倍,CO的转化率为α1,则平衡时CO的物质的量为(1-α1)mol,乙中平衡时NO的转化率为α2,乙中平衡时CO的物质的量为2α2mol,故2(1-α1)=2α2,整理得α1+α2=1;
令平衡时甲中CO为nmol,则乙中CO为2nmol,甲中放出的热量为(1-n)×234kJ=akJ,乙中吸收的热量为2n×234kJ=bkJ,整理得a+b/2=234;
丙与乙是完全等效平衡,平衡时NO的浓度相等,故m=3mol·L-1,
故答案为:1;234;3mol·L-1.
考点:化学平衡常数的含义;化学平衡建立的过程;化学平衡的计算

 科学实验活动册系列答案
科学实验活动册系列答案I.科学家一直致力于“人工固氮”的方法研究。目前合成氨的技术原理为氮气和氢气在高温高压催化剂条件下生成氨气,一定条件下,向一个2L的密闭容器中充入2molN2和6molH2,反应达平衡时生成NH3的浓度为0.5mol/L,并放出QkJ热量,该反应的热化学方程式可表示为______。
II.已知:N2O4(g) 2NO2(g) △H=+57.20kJ/mol。
2NO2(g) △H=+57.20kJ/mol。
在1000C时,将0.100molN2O4气体充入lL恒容抽空的密闭容器中,每隔一定时间对该容器内的物质浓度进行分析得到下表数据:
| 时间(s) | 0 | 20 | 40 | 60 | 80 |
| c(N2O4)/mol | 0.100 | c1 | 0.050 | c3 | c4 |
| c(NO2)/mol | 0.000 | 0.060 | c2 | 0.120 | 0.120 |
(1)该反应的平衡常数表达式为______;从表中数据分析:c1______c2、c3______c4(选填“>”、“<”或“=”)。
(2)在右图中画出并标明此反应中N2O4和NO2的浓度随时间变化的曲线。

(3)在上述条件下,从反应开始至达到化学平衡时,四氧化二氮的平均反应速率为______。
(4)若起始时充入NO2气体0.200mol,则达到平衡时NO2气体的转化率为______;其它条件不变时,下列措施能提高NO2转化率的是______ (填字母)。
A.减小NO2的浓度 B.降低温度 C.增加NO2的浓度
D.升高温度 E.再充入一定量的He
(5)向容积相同、温度分别为T1和T1的两个密闭容器中分别充入等量NO2,发生反应:2NO2
 N2O4(g)(g) △H=-57.20kJ/mol。恒温恒容下反应相同时间后,分别测得体系中NO2的百分含量分别为a1和a2。巳知T1<T2,则a1____a2(选择A、B、C、D填空)。
N2O4(g)(g) △H=-57.20kJ/mol。恒温恒容下反应相同时间后,分别测得体系中NO2的百分含量分别为a1和a2。巳知T1<T2,则a1____a2(选择A、B、C、D填空)。A.大于 B.小于 C.等于 D.以上都有可能
工业碳酸钠(纯度约为98%)中含有Ca2+、Mg2+、Fe3+、Cl-和SO42—等杂质,提纯工艺线路如图所示:
Ⅰ.碳酸钠的饱和溶液在不同温度下析出的溶质如图所示: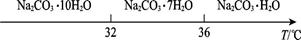
Ⅱ.有关物质的溶度积如下
| 物质 | CaCO3 | MgCO3 | Ca(0H)2 | Mg(OH)2 | Fe(OH)3 |
| Ksp | 4.96×10-9 | 6.82×10-6 | 4.68×10-6 | 5.61×10-12 | 2.64×10-39 |
回答下列问题:
(1)加入NaOH溶液时,反应的离子方程式为 。向含有Mg2+、Fe3+的溶液中滴加NaOH溶液,当两种沉淀共存且溶液的pH=8时,c(Mg2+):c(Fe3+)= 。
(2)“母液”中除了含有Na+、CO32—外,还含有 等离子。
(3)有人从“绿色化学”角度设想将“母液”沿流程中虚线进行循环使用。请你分析在实际工业生产中是否可行: (填“可行”或“不可行”),并说明理由: 。
(4)已知:Na2CO3·10H2O(s)
 Na2CO3(s)+10H2O(g)
Na2CO3(s)+10H2O(g) ="+532.36" kJ·mol-1
="+532.36" kJ·mol-1Na2CO3·10H2O(s)
 Na2CO3·H2O(s)+9H2O(g)
Na2CO3·H2O(s)+9H2O(g)  ="+473.63" kJ·mol-1
="+473.63" kJ·mol-1写出Na2CO3·H2O脱水反应的热化学方程式: 。
 2SO3(g),反应过程的能量变化如图所示。已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH=-99 kJ/mol。
2SO3(g),反应过程的能量变化如图所示。已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH=-99 kJ/mol。
 CH3OH+H2O,测得甲醇的理论产率与反应温度、压强的关系如图所示。请回答下列问题:
CH3OH+H2O,测得甲醇的理论产率与反应温度、压强的关系如图所示。请回答下列问题:
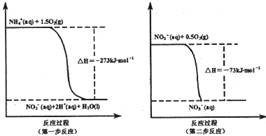
 2CO2+ N2 △H
2CO2+ N2 △H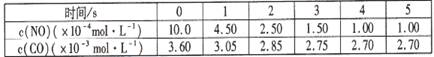

 CO(NH2)2(l)+H2O(g)在合成塔中进行。下图中Ⅰ、Ⅱ、Ⅲ三条曲线为合成塔中按不同氨碳比 [n(NH3)/n(CO2)]和水碳比[n(H2O)/n(CO2)]投料时二氧化碳转化率的情况。
CO(NH2)2(l)+H2O(g)在合成塔中进行。下图中Ⅰ、Ⅱ、Ⅲ三条曲线为合成塔中按不同氨碳比 [n(NH3)/n(CO2)]和水碳比[n(H2O)/n(CO2)]投料时二氧化碳转化率的情况。
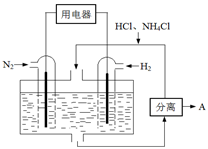
 N2(g)+2CO2(g)的△H是 。
N2(g)+2CO2(g)的△H是 。 CH3OH(g)。
CH3OH(g)。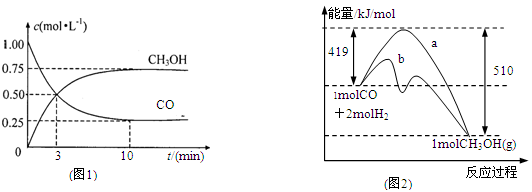
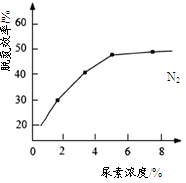
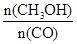 增大的有
增大的有