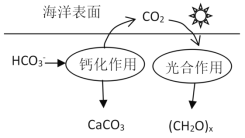
题目内容
【题目】某离子反应中涉及![]() 六种微粒,其中
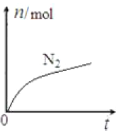
六种微粒,其中![]() 的物质的量随时间变化的曲线如图所示。下列判断正确的是( )
的物质的量随时间变化的曲线如图所示。下列判断正确的是( )
A.该反应的氧化剂是![]() ,还原产物是
,还原产物是![]() B.消耗
B.消耗![]() 还原剂,转移
还原剂,转移![]() 电子
电子
C.氧化剂与还原剂的物质的量之比为![]() D.水是生成物,且反应后溶液的酸性明显增强
D.水是生成物,且反应后溶液的酸性明显增强
【答案】D
【解析】
由图可知,随着反应进行,N2的量逐渐增加,说明N2是产物;又因为含氮元素的粒子,除N2外,只有![]() ,所以N2是由
,所以N2是由![]() 被氧化生成的氧化产物;N元素反应过程中价态升高,考虑整个反应涉及的所有粒子种类,所以降价元素是Cl,反应前以ClO-形式存在,反应后被还原为Cl-;因此整个反应的离子方程式可以写成:
被氧化生成的氧化产物;N元素反应过程中价态升高,考虑整个反应涉及的所有粒子种类,所以降价元素是Cl,反应前以ClO-形式存在,反应后被还原为Cl-;因此整个反应的离子方程式可以写成:![]() 。
。
A.通过分析可知,N2是该反应的氧化产物,A项错误;
B.通过分析可知,该反应的还原剂是![]() ,其中的N元素被氧化为0价,所以1mol还原剂被消耗,转移3mol电子,B项错误;
,其中的N元素被氧化为0价,所以1mol还原剂被消耗,转移3mol电子,B项错误;
C.通过分析可知,该反应的氧化剂和还原剂的物质的量之比为3:2,C项错误;
D.通过分析可知,水是该反应的生成物,该反应还生成了H+,所以反应后的溶液酸性增强,D项正确;
答案选D。

 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案【题目】氯化镁纯品为无色单斜晶体,工业品通常呈黄褐色,有苦咸味。该物质可以形成六水合物,即六水氯化镁(MgCl2·6H2O),以下流程为由某混合物,制取纯净MgCl2·6H2O的生产过程:

已知:在本流程中,
Fe3+ | Fe2+ | Al3+ | Mg2+ | |
开始沉淀pH | 1.5 | 6.5 | 3.3 | 8.4 |
完全沉淀pH | 4.1 | 9.7 | 5.5 | 10.9 |
试回答下列问题:
(1)操作1所需玻璃仪器为____________________。
(2)流程中加入试剂2调节pH的范围是________;加入试剂2能形成沉淀的原因是___________________。
(3)操作3为加入足量的盐酸,然后经过___________、____________,过滤,洗涤,干燥;在操作不当的情况下,若MgCl2·6H2O受热则会发生水解形成碱式盐,则该反应的化学方程式为____________________。
(4)若25℃下,Ksp[Mg(OH)2]=4×10-12,则该温度下,将Mg(OH)2溶于水形成饱和溶液,则其饱 和溶液的pH=_________。(已知:lg5=0.7)