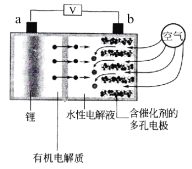
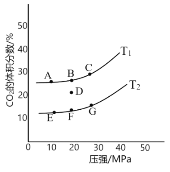
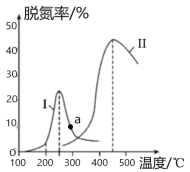
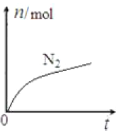
题目内容
【题目】研究CO2在海洋中的转移和归宿,是当今海洋科学研究的前沿领域。溶于海水的CO2主要以4种无机碳形式存在,其中HCO3-占95%,在海洋循环中,通过下图所示的途径固碳。以下选项中相关说法不正确的是( )
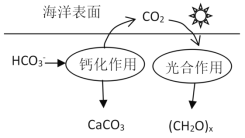
A.NaHCO3溶液中存在:c(H2CO3)+c(HCO3- )+c(OH-)=c(H+)
B.钙化作用的离子方程式为Ca2+ +2HCO3- ═CaCO3↓+CO2↑ + H2O
C.Na2CO3溶液中:c(Na+)>c(CO32-)>c(OH-)>c(HCO3- )>c(H+)
D.若将标况下2.24 L CO2气体通入足量的NaOH溶液,所得溶液中存在:n(H2CO3)+n(HCO3- )+n(CO32-)=0.1 mol
【答案】A
【解析】
A. 根据质子守恒可知NaHCO3溶液中存在:c(HCO3-)+c(OH-)=c(H2CO3)+c(H+),A错误;
B. 钙化作用的离子方程式为Ca2++2HCO3-=CaCO3↓+CO2↑+H2O,B正确;
C. 碳酸根水解,溶液显碱性,Na2CO3溶液中:c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+),C正确;
D. 若将标况下2.24 L CO2气体通入足量的NaOH溶液生成0.1mol碳酸钠,根据物料守恒可知所得溶液中存在:n(H2CO3)+n(HCO3-)+n(CO32-)=0.1 mol,D正确;
答案选A。

 备战中考寒假系列答案
备战中考寒假系列答案【题目】合成氨工业是贵州省开磷集团的重要支柱产业之一。氨是一种重要的化工原料,在工农业生产中有广泛的应用。
(1)在一定温度下,在固定体积的密闭容器中进行可逆反应:N2(g)+3H2(g)![]() 2NH3(g)。该可逆反应达到平衡的标志是___。
2NH3(g)。该可逆反应达到平衡的标志是___。
a.3v正(H2)=2v逆(NH3)
b.单位时间生成mmolN2的同时生成3mmolH2
c.容器内的总压强不再随时间而变化
d.混合气体的密度不再随时间变化
(2)工业上可用天然气原料来制取合成氨的原料气氢气。某研究性学习小组的同学模拟工业制取氢气的
原理,在一定温度下,体积为2L的恒容密闭容器中测得如下表所示数据。请回答下列问题:
时间/min | CH4(mol) | H2O(mol) | CO(mol) | H2(mol) |
0 | 0.40 | 1.00 | 0 | 0 |
5 | a | 0.80 | c | 0.60 |
7 | 0.20 | b | 0.20 | d |
10 | 0.21 | 0.81 | 0.19 | 0.64 |
①写出工业用天然气原料制取氢气的化学方程式:___。
②分析表中数据,判断5min时反应是否处于平衡状态?___(填“是”或“否”),前5min反应的平均反应速率v(CH4)=___。
③反应在7~10min内,CO的物质的量减少的原因可能是___ (填字母)。
a.减少CH4的物质的量 b.降低温度 c.升高温度 d.充入H2