题目内容
【题目】NA 为阿伏加德罗常数的值,下列说法不正确的是( )
A.0.l mol Cl2与足量的铁粉充分反应转移的电子数为 0.2 NA
B.1.0 mol CH4 与Cl2 在光照下反应生成的 CH3Cl 分子数为 1.0 NA
C.标准状况下,11.2 L甲烷和乙烯(C2H4)混合物中含氢原子数目为2 NA
D.0.1mol Cl2 通入水中,HClO、Cl-、ClO-粒子数之和小于 0.2 NA
【答案】B
【解析】
A.氯气与铁粉反应时生成氯化铁,则0.l mol Cl2与足量的铁粉充分反应转移的电子数为 0.2 NA,故A正确;
B.氯气与甲烷光照时发生反应生成氯化氢、一氯甲烷、二氯甲烷、三氯甲烷和四氯化碳,则1.0 mol CH4 与Cl2 在光照下反应生成的 CH3Cl 分子数小于1.0 NA,故B错误;
C.甲烷和乙烯分子中均含有4个氢原子,甲烷和乙烯的物质的量之和为![]() ,则混合物中含氢原子数目为0.5× 4NA= 2 NA,故C正确;
,则混合物中含氢原子数目为0.5× 4NA= 2 NA,故C正确;
D.氯气与水反应为可逆反应,0.1mol Cl2 通入水中,溶液中存在氯气分子、HClO、Cl-、ClO-等粒子,根据原子守恒,HClO、Cl-、ClO-粒子数之和小于 0.2 NA,故D正确;
综上所述,答案为B。

【题目】重金属元素铬的毒性较大,含铬废水需经处理达标后才能排放。
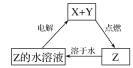
Ⅰ.某工业废水中主要含有Cr3+,同时还含有少量的Fe2+、Fe3+、Al3+、Ca2+和Mg2+等,且酸性较强。为回收利用,通常采用如下流程处理:
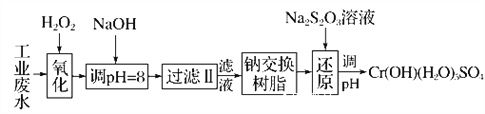
注:常温下,部分阳离子以氢氧化物形式完全沉淀时所需的pH,如下表:
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Mg(OH)2 | Al(OH)3 | Cr(OH)3 |
pH | 3.7 | 9.6 | 11.1 | 8 | 9 |
(1)氧化过程中可代替H2O2加入的试剂是________(填字母,下同)。
A.Na2O2 B.HNO3 C.FeCl3 D.KMnO4
(2)加入NaOH溶液调整溶液pH=8时,除去的离子是________;
已知钠离子交换树脂的原理:Mn++nNaR―→MRn+nNa+,此步操作被交换除去的杂质离子是____________。
A.Fe3+ B.Al3+ C.Ca2+ D.Mg2+
(3)还原过程在酸性条件下进行,每消耗0.8 mol Cr2O![]() 转移4.8 mol e-,该反应离子方程式为________________________________________________________________________。
转移4.8 mol e-,该反应离子方程式为________________________________________________________________________。
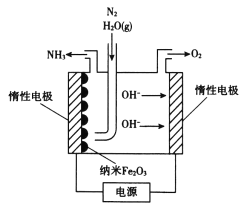
Ⅱ.酸性条件下,六价铬主要以Cr2O![]() 形式存在,工业上常用电解法处理含Cr2O
形式存在,工业上常用电解法处理含Cr2O![]() 的废水,该法用Fe作电极电解含Cr2O
的废水,该法用Fe作电极电解含Cr2O![]() 的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3溶液。
的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3溶液。
(1)电解时能否用Cu电极来代替Fe电极?________(填“能”或“不能”),理由是_____________。
(2)常温下,Cr(OH)3的溶度积Ksp=1×10-20,假设溶液的c(Cr3+)=0.01mol/L,当pH应为______时开始生成沉淀。
【题目】“绿水青山就是金山银山”,研究NO2、NO、CO等大气污染物处理对建设美丽中国具有重要意义。
(1)已知: ①NO2+CO![]() CO2+NO该反应的平衡常数为K1(下同),每1mol 下列物质分解为气态基态原子消耗能量(即分子的总键能)分别为:
CO2+NO该反应的平衡常数为K1(下同),每1mol 下列物质分解为气态基态原子消耗能量(即分子的总键能)分别为:
NO2 | CO | CO2 | NO |
812kJ | 1076kJ | 1490kJ | 632kJ |
②N2(g)+O2(g) ![]() 2NO(g) △H=+ 179.5 kJ /mol K2
2NO(g) △H=+ 179.5 kJ /mol K2
③2NO(g) + O2(g) ![]() 2NO2(g) △H=-112.3kJ/mol K3
2NO2(g) △H=-112.3kJ/mol K3
试写出NO与CO反应生成无污染的N2和CO2的热化学方程式_______________________以及此热化学方程式的平衡常数K=________(用K1、 K2、K3表示)
(2)污染性气体NO2与CO在一定条件下的反应为:2NO2+4CO![]() 4CO2+N2,某温度下,在1L密闭容器中充入0.1molNO2和0.2molCO,此时容器的压强为1个大气压,5秒时反应达到平衡时,容器的压强变为原来的29/30,则反应开始到平衡时CO的平均反应速率v(CO)=_____。
4CO2+N2,某温度下,在1L密闭容器中充入0.1molNO2和0.2molCO,此时容器的压强为1个大气压,5秒时反应达到平衡时,容器的压强变为原来的29/30,则反应开始到平衡时CO的平均反应速率v(CO)=_____。