题目内容
【题目】t℃时CuSO4的溶解度是Sg,其饱和溶液密度为dg·cm-3,物质的量浓度为cmol·L-1。向足量饱和溶液中加入mg无水CuSO4或蒸发掉ng水后恢复t℃,均能获得Wg胆矾晶体,下列关系式正确的是
A. c=![]() mol·L-1 B. S=
mol·L-1 B. S=![]() g
g
C. m=![]() g D. W=
g D. W=![]() g
g
【答案】C
【解析】
A.考查c、d、S的代数关系.t℃时CuSO4的溶解度是S g,设100g水与Sg CuSO4可形成饱和溶液,则所得饱和溶液质量=(100+S)g,溶质硫酸铜物质的量=![]() mol,而所得饱和溶液的体积=
mol,而所得饱和溶液的体积=![]() ×10-3L,故物质的量浓度C=
×10-3L,故物质的量浓度C= =
=![]() mol/L ,故A错误;
mol/L ,故A错误;
B. 考查S、W、n的代数关系.饱和溶液蒸发掉ng水恢复到t℃时,获得Wg CuSO45H2O晶体,逆向思维即再加入(蒸发掉的)n g水时,Wg胆矾晶体就可恰好溶解恢复到原饱和溶液,即n g水与Wg CuSO45H2O可形成饱和溶液,饱和溶液中溶质质量=W×![]() g,溶液的质量=(n+W)g,此时硫酸铜的溶解度S=
g,溶液的质量=(n+W)g,此时硫酸铜的溶解度S= 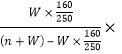 100g=
100g=![]() g;故B错误;
g;故B错误;
C.考查S、m、n的代数关系.加入m g无水CuSO4或蒸发掉n g水后恢复到t℃,均能获得W g胆矾晶体,说明n g水中溶解m g无水CuSO4恰好成饱和溶液,此时硫酸铜溶解度S=![]() g,则m=
g,则m=![]() g;故C正确;
g;故C正确;
D. 考查W、S、m的代数关系,加入mg的无水CuSO4与饱和溶液中的水反应而使饱和溶液因水减少而析出晶体,Wg硫酸铜晶体中所含结晶水质量=Wg×![]() 、所含硫酸铜的质量=Wg×
、所含硫酸铜的质量=Wg×![]() ,而其中(W×
,而其中(W×![]() ×100%-m)g硫酸铜完全溶解于Wg×
×100%-m)g硫酸铜完全溶解于Wg×![]() 水恰好成为饱和溶液,则:
水恰好成为饱和溶液,则:![]() =
= ,则析出晶体质量W=
,则析出晶体质量W=![]() g;故D错误。
g;故D错误。
本题答案为C。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目



