题目内容
1.下列各组离子在给定条件下能大量共存的是( )| A. | 强酸性溶液中:NH4+、K+、CO32-、Cl- | |
| B. | 有SO42-存在的溶液中:Na+、Mg2+、Ba2+、I- | |
| C. | 加入铝粉能放出氢气的溶液中:K+、Ba2+、Cl-、Br- | |
| D. | 在强碱性的溶液中:NH4+、Na+、Cl-、H+ |
分析 A.强酸性溶液中存在大量氢离子,碳酸根离子与氢离子反应;
B.硫酸根离子与钡离子反应生成硫酸钡沉淀;
C.加入铝粉能放出氢气的溶液中存在大量氢离子或氢氧根离子,四种离子之间不发生反应,都不与氢离子和氢氧根离子反应;
D.强碱性溶液中存在大量氢氧根离子,铵根离子和氢离子都与氢氧根离子反应.
解答 解:A.CO32-与强酸性溶液中的氢离子发生反应,在溶液中不能大量共存,故A错误;
B.SO42-与Ba2+发生反应生成难溶物硫酸钡,在溶液中不能大量共存,故B错误;
C.加入铝粉能放出氢气的溶液为酸性或强碱性溶液,溶液中存在大量氢离子或氢氧根离子,K+、Ba2+、Cl-、Br-离子之间不发生反应,都不与氢离子和氢氧根离子反应,在溶液中能够大量共存,故C正确;
D.NH4+、H+都与强碱性溶液中的氢氧根离子发生反应,在溶液中不能大量共存,故D错误;
故选C.
点评 本题考查了离子共存的判断,题目难度中等,明确离子反应发生条件及题干隐含条件为解答关键,注意掌握判断离子共存的常用方法,试题侧重考查学生的分析、理解能力及灵活应用基础知识的能力.

练习册系列答案
相关题目
11.将Mg、Cu组成的2.64g混合物投入适量稀硝酸中恰好完全反应,固体完全溶解时收集到还原产物NO气体0.896L(标准状况),向反应后的溶液中加入一定体积1mol•L-1的NaOH溶液恰好使金属离子沉淀完全,则加入NaOH溶液的体积为( )
| A. | 80ml | B. | 120ml | C. | 150ml | D. | 200ml |
9.下列化学用语表达正确的是( )
| A. | 一氯乙烷的结构式CH3Cl | B. | 丁烷的结构简式CH3CH2CH2CH3 | ||
| C. | 四氯化碳的电子式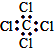 | D. | 乙烷的分子式 (CH3)2 |
16.阳离子X+的核外电子排布为2、8,则X元素在周期表中的位置是( )
| A. | 第三周期第0族 | B. | 第三周期第ⅦA族 | C. | 第三周期第ⅠA族 | D. | 第ⅠA族第四周期 |
6.如图,在锌、铜和硫酸组成的原电池中,负极发生的反应是( )
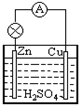

| A. | Zn-2e-=Zn2+ | B. | Cu-2e-=Cu2+ | C. | 2H++2e-=H2↑ | D. | Cu2++2e-=Cu |
13.根据总反应式:Zn+Cu2+=Zn2++Cu,请分析下述原电池的组成,对应正确的一组是( )
| A | B | C | D | |
| 正极 | Cu | Cu | Zn | Ag |
| 负极 | Zn | Zn | Cu | Cu |
| 电解质溶液 | CuSO4 | AgNO3 | CuCl2 | CuSO4 |
| A. | A | B. | B | C. | C | D. | D |
10.常温下,0.1mol•L-1HX的pH=1,0.1mol•L-1CH3COOH的pH=2.9.下列说法不正确的是( )
| A. | HX和CH3COOH均可抑制水的电离 | |
| B. | 将HX与CH3COOH 各0.1mol溶于水配成1L混合溶液,则溶液的c(H+)=0.2 mol•L-1 | |
| C. | 将等物质的量浓度、等体积的HX与CH3COONa两溶液混合后所得溶液中:c(Na+)>c(CH3COOH)>c(CH3COO-)>c(H+) | |
| D. | 0.3mol•L-1的CH3COOK溶液:c(CH3COO-)+c(CH3COOH)=c(K+) |
11.利用如图所示装置进行下列实验,能得出相应实验结论的是( )
| 选项 | ① | ② | ③ | 实验结论 |  |
| A | 浓盐酸 | MnO2 | NaBr溶液 | 氧化性Cl2>Br2 | |
| B | 浓硫酸 | Na2SO3 | FeCl3溶液 | SO2具有还原性 | |
| C | 浓氨水 | 生石灰 | AlCl3溶液 | Al(OH)3具有两性 | |
| D | 醋酸 | Na2CO3 | Na2SiO3 | 非金属性:C>Si |
| A. | A | B. | B | C. | C | D. | D |


 ;
; ,在核磁共振氢谱中出现5组峰.
,在核磁共振氢谱中出现5组峰.