题目内容
16.阳离子X+的核外电子排布为2、8,则X元素在周期表中的位置是( )| A. | 第三周期第0族 | B. | 第三周期第ⅦA族 | C. | 第三周期第ⅠA族 | D. | 第ⅠA族第四周期 |
分析 阳离子X+的核外电子排布为2、8,则X元素原子核外有3个电子层、最外层电子数为1,核外电子数为2+8+1=11,主族元素周期数=电子层数、主族族序数=最外层电子数.
解答 解:阳离子X+的核外电子排布为2、8,则X元素原子核外有3个电子层、最外层电子数为1,故处于第三周期IA族,故选C.
点评 本题考查结构性质位置关系应用,注意把握原子结构与元素位置的关系,注重基础知识的考查,题目难度不大.

练习册系列答案
 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案
相关题目
6.将水蒸气通过红热的碳可产生水煤气,以此产物为原料可生产多种产品.
(1)已知:C(s)+H2O(g)?CO(g)+H2(g)△H=+131.3kJ/mol,达到平衡后,体积不变时,能提高H2O的平衡转化率的措施是AD.
A.升高温度B.增加碳的用量C.加入催化剂D.用储氢金属吸收H2

(2)某些合金可用于储存氢,金属储氢的原理可表示为:M(s)+xH2(g)?MH2(s)△H<0(M表示某种合金).如图1表示温度分别为T1、T2时,最大吸氢量与氢气压强的关系,则T1<T2(填“<”、“>”或“=”).
(3)某温度下,在2L体积不变的密闭容器中将1molCO和2molH2混合发生反应:CO(g)+2H2(g)?CH3OH(g),测得不同时刻的反应前后压强关系如表:
反应在前10min的平均速率v(H2)=0.015mol•L-1•min-1.达到平衡时CO的转化率为51%.
(4)CO可以还原某些金属氧化物生成金属单质和CO2,如图2是四种金属氧化物被CO还原时1g[$\frac{c(CO)}{c(C{O}_{2})}$)]与温度(T)的关系曲线图.
①其中最易被还原的金属氧化物是Cu2O(填化学式).
②700℃时CO还原Cr2O3反应中的平衡常数k=10-12.
(5)水煤气处理后,获得的较纯H2用于合成氨:N2(g)+3H2(g)?2NH3(g),△H=-92.4kJ•mol-1.如图3为不同实验条件下进行合成氨反应实验,N2浓度随时间变化示意图.
①与实验Ⅰ比较,实验Ⅱ改变的条件为使用催化剂.
②实验Ⅲ比实验Ⅰ的温度要高,其它条件相同,请在图4中画出实验Ⅰ和实验Ⅲ中NH3浓度随时间变化的示意图 .
.
(6)饮用水中的NO3-主要来自于NH4+,已知在微生物作用下,NH4+经过两步反应被氧化成NO3-,两步反应的能量变化示意图如图5.请写出1molNH4+(aq)的热化学方程式NH4+(aq)+2O2(g)═2H+(aq)+H2O(l)+NO3-(aq),△H=-346 kJ/mol.

(1)已知:C(s)+H2O(g)?CO(g)+H2(g)△H=+131.3kJ/mol,达到平衡后,体积不变时,能提高H2O的平衡转化率的措施是AD.
A.升高温度B.增加碳的用量C.加入催化剂D.用储氢金属吸收H2

(2)某些合金可用于储存氢,金属储氢的原理可表示为:M(s)+xH2(g)?MH2(s)△H<0(M表示某种合金).如图1表示温度分别为T1、T2时,最大吸氢量与氢气压强的关系,则T1<T2(填“<”、“>”或“=”).
(3)某温度下,在2L体积不变的密闭容器中将1molCO和2molH2混合发生反应:CO(g)+2H2(g)?CH3OH(g),测得不同时刻的反应前后压强关系如表:
| 时间(min) | 5 | 10 | 15 | 20 | 25 | 30 |
| 压强比($\frac{{P}_{后}}{{P}_{前}}$) | 0.98 | 0.90 | 0.78 | 0.66 | 0.66 | 0.66 |
(4)CO可以还原某些金属氧化物生成金属单质和CO2,如图2是四种金属氧化物被CO还原时1g[$\frac{c(CO)}{c(C{O}_{2})}$)]与温度(T)的关系曲线图.
①其中最易被还原的金属氧化物是Cu2O(填化学式).
②700℃时CO还原Cr2O3反应中的平衡常数k=10-12.
(5)水煤气处理后,获得的较纯H2用于合成氨:N2(g)+3H2(g)?2NH3(g),△H=-92.4kJ•mol-1.如图3为不同实验条件下进行合成氨反应实验,N2浓度随时间变化示意图.
①与实验Ⅰ比较,实验Ⅱ改变的条件为使用催化剂.
②实验Ⅲ比实验Ⅰ的温度要高,其它条件相同,请在图4中画出实验Ⅰ和实验Ⅲ中NH3浓度随时间变化的示意图
 .
.(6)饮用水中的NO3-主要来自于NH4+,已知在微生物作用下,NH4+经过两步反应被氧化成NO3-,两步反应的能量变化示意图如图5.请写出1molNH4+(aq)的热化学方程式NH4+(aq)+2O2(g)═2H+(aq)+H2O(l)+NO3-(aq),△H=-346 kJ/mol.

7.下列说法中,正确的是( )
| A. | s区元素都是金属元素 | B. | p区元素全部都是非金属元素 | ||
| C. | d区、ds区和f区由副族元素组成 | D. | s区和p区由主族和0族元素组成 |
4.以下说法正确的是( )
| A. | 金属元素与非金属元素的原子间只形成离子键 | |
| B. | 原子或离子间相互的吸引力叫化学键 | |
| C. | 非金属元素间只能形成共价键 | |
| D. | 共价化合物内部可能有极性键和非极性键 |
11.已知烯烃在一定条件下氧化时,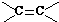 键断裂.如RCH═CHR′可氧化成RCHO和R′CHO,下列烯烃中,经氧化可得到乙醛和丁醛的是( )
键断裂.如RCH═CHR′可氧化成RCHO和R′CHO,下列烯烃中,经氧化可得到乙醛和丁醛的是( )
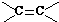 键断裂.如RCH═CHR′可氧化成RCHO和R′CHO,下列烯烃中,经氧化可得到乙醛和丁醛的是( )
键断裂.如RCH═CHR′可氧化成RCHO和R′CHO,下列烯烃中,经氧化可得到乙醛和丁醛的是( )| A. | 1-己烯 | B. | 2-己烯 | C. | 3-已烯 | D. | 2-甲基-2-戊烯 |
1.下列各组离子在给定条件下能大量共存的是( )
| A. | 强酸性溶液中:NH4+、K+、CO32-、Cl- | |
| B. | 有SO42-存在的溶液中:Na+、Mg2+、Ba2+、I- | |
| C. | 加入铝粉能放出氢气的溶液中:K+、Ba2+、Cl-、Br- | |
| D. | 在强碱性的溶液中:NH4+、Na+、Cl-、H+ |
8.下列粒子半径比较中,正确的是( )
| A. | Na+<Mg2+<Al3+<K+ | B. | S2->Cl->K+>Ca2+ | ||
| C. | O2->S2->Cl->Br- | D. | F->Li+>Na+>S2- |
5.有机物的命名是有规则的,下列有机物用系统命名法命名正确的是( )
| A. | 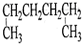 1,4-二甲基丁烷 | B. | 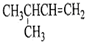 3-甲基丁烯 | C. | 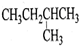 2-甲基丁烷 | D. | 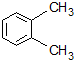 邻二甲苯 |
6.以下事实,表明硝酸具有强氧化性的是( )
| A. | 硝酸可以和大理石反应 | |
| B. | 氢氧化铁沉淀可溶于硝酸 | |
| C. | 分别蘸有浓硝酸和浓氨水的两根玻璃棒靠近时,出现浓烈白烟 | |
| D. | 铜片投入浓硝酸,立刻发生剧烈反应,放出棕红色气体 |