题目内容
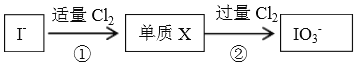
【题目】下图是无机物A~M 在一定条件下的转化关系(部分产物及反应条件来列出)。其中,I是由地壳中含量最多的金属元素组成的单质,K是一种红棕色气体, C 是一种强酸。

请填写下列空白:
(1)写出下列物质的化学式:A:___________ E:_____________。
(2)写出反应④的离子方程式:______________________。
写出反应⑦的化学方程式:______________________。
写出反应⑩的化学方程式:______________________。
(3)在反应②、③、⑥、⑧、⑨中,既属于化合反应又属于氧化还原反应的__________________(填写序号) 。
(4)写出检验M溶液中阳离子的方法:______________________。
(5)将化合物D与KNO3、KOH高温共融,可制得一种“绿色”环保高效净水剂K2FeO4 (高铁酸钾),同时还生成KNO2和H2O。写出该反应的化学方程式并用双线桥标出电子转移方向和数目:___________。
(6)ClO2也是绿色净水剂,ClO2制备方法较多,我国科学家探索的新方法是:氯气(Cl2)和固体亚氯酸钠(NaClO2)反应,写出该反应的化学方程式:__________________。
【答案】 SO2 Fe(OH)3 3Fe2++4H++NO3-=3Fe3++NO↑+2H2O 2Al+Fe2O3![]() 2Fe+Al2O3 3Fe+8HNO3=3Fe(NO3)2+2NO↑+4H2O ②⑧ 加入KSCN无现象,再加入氯水溶液显血红色则有Fe2+(其他合理答案也可)
2Fe+Al2O3 3Fe+8HNO3=3Fe(NO3)2+2NO↑+4H2O ②⑧ 加入KSCN无现象,再加入氯水溶液显血红色则有Fe2+(其他合理答案也可) 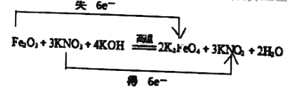 Cl2+2NaClO2=2ClO2+2NaCl
Cl2+2NaClO2=2ClO2+2NaCl
【解析】I是由地壳中含量最多的金属元素组成的单质,I是铝。K是一种红棕色气体,K是二氧化氮,所以L是NO,J是硝酸溶液。由反应4FeS2+11O2![]() 2Fe2O3+8SO2可知D为Fe2O3、A为SO2,B为SO3,C是一种强酸,C为硫酸;G、H为Al2O3和Fe中的一种;由G+HNO3→M+NO↑分析可知G为Fe,H为Al2O3;M应为硝酸铁或硝酸亚铁;联系反应④:M+H2SO4→F+NO↑知,M为硝酸亚铁;F为硝酸铁;E应氢氧化铁,氢氧化铁分解生成氧化铁,氧化铁与铝发生铝热反应生成铁和氧化铝。
2Fe2O3+8SO2可知D为Fe2O3、A为SO2,B为SO3,C是一种强酸,C为硫酸;G、H为Al2O3和Fe中的一种;由G+HNO3→M+NO↑分析可知G为Fe,H为Al2O3;M应为硝酸铁或硝酸亚铁;联系反应④:M+H2SO4→F+NO↑知,M为硝酸亚铁;F为硝酸铁;E应氢氧化铁,氢氧化铁分解生成氧化铁,氧化铁与铝发生铝热反应生成铁和氧化铝。
(1)根据以上分析可知A、E的化学式分别是SO2、Fe(OH)3。(2)反应④的离子方程式为3Fe2++4H++NO3-=3Fe3++NO↑+2H2O。反应⑦的化学方程式为2Al+Fe2O3![]() 2Fe+Al2O3。反应⑩的化学方程式为3Fe+8HNO3=3Fe(NO3)2+2NO↑+4H2O。(3)根据以上分析可知在反应②、③、⑥、⑧、⑨中,既属于化合反应又属于氧化还原反应的②⑧。(4)检验M溶液中亚铁离子的方法为加入KSCN无现象,再加入氯水溶液显血红色则有Fe2+。(5)铁元素化合价从+3价升高到+6价,失去3个电子,氮元素化合价从+5价降低到+3价,得到2个电子,根据电子得失守恒可知反应的方程式为Fe2O3+3KNO3+4KOH
2Fe+Al2O3。反应⑩的化学方程式为3Fe+8HNO3=3Fe(NO3)2+2NO↑+4H2O。(3)根据以上分析可知在反应②、③、⑥、⑧、⑨中,既属于化合反应又属于氧化还原反应的②⑧。(4)检验M溶液中亚铁离子的方法为加入KSCN无现象,再加入氯水溶液显血红色则有Fe2+。(5)铁元素化合价从+3价升高到+6价,失去3个电子,氮元素化合价从+5价降低到+3价,得到2个电子,根据电子得失守恒可知反应的方程式为Fe2O3+3KNO3+4KOH![]() 2K2FeO4+3KNO2+2H2O,双线桥标出电子转移方向和数目为
2K2FeO4+3KNO2+2H2O,双线桥标出电子转移方向和数目为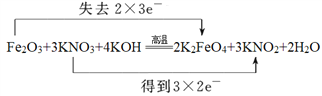 。(6)根据原子守恒可知还有氯化钠生成,该反应的化学方程式为Cl2+2NaClO2=2ClO2+2NaCl。
。(6)根据原子守恒可知还有氯化钠生成,该反应的化学方程式为Cl2+2NaClO2=2ClO2+2NaCl。

 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
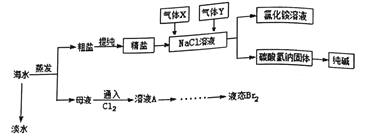
口算题卡河北少年儿童出版社系列答案【题目】工业上设计将VOSO4中的K2SO4、SiO2杂质除去并回收得到V2O5的流程如下: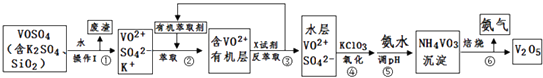
请回答下列问题:
(1)步骤①所得废渣的成分是(写化学式),操作I的名称 .
(2)步骤②、③的变化过程可简化为(下式R表示VO2+ , HA表示有机萃取剂):R2(SO4)n (水层)+2nHA(有机层)2RAn(有机层)+nH2SO4 (水层)
②中萃取时必须加入适量碱,其原因是 .
③中X试剂为 .
(3)⑤的离子方程式为 .
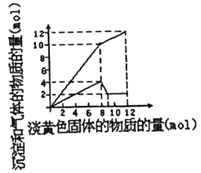
(4)25℃时,取样进行试验分析,得到钒沉淀率和溶液pH之间关系如下表:
pH | 1.3 | 1.4 | 1.5 | 1.6 | 1.7 | 1.8 | 1.9 | 2.0 | 2.1 |
钒沉淀率% | 88.1 | 94.8 | 96.5 | 98.0 | 98.8 | 98.8 | 96.4 | 93.1 | 89.3 |
结合上表,在实际生产中,⑤中加入氨水,调节溶液的最佳pH为;若钒沉淀率为93.1%时不产生Fe(OH)3沉淀,则溶液中c(Fe3+)< .
(5)该工艺流程中,可以循环利用的物质有和 .
【题目】Na2SO3溶液做为吸收液吸收SO2时,吸收液pH随n( ![]() ):n(
):n( ![]() )变化的关系如表:
)变化的关系如表:
n( | 91:9 | 1:1 | 9:91 |
Ph | 8.2 | 7.2 | 6.2 |
以下离子浓度关系的判断正确的是( )
A.NaHSO3溶液中c(H+)<c(OH﹣)
B.Na2SO3溶液中c(Na+)>c (SO ![]() )>c(HSO
)>c(HSO ![]() )>c(OH﹣)>c(H+)
)>c(OH﹣)>c(H+)
C.当吸收液呈中性时,c(Na+)>c(SO ![]() )>c(HSO
)>c(HSO ![]() )>c(OH﹣)=c(H+)
)>c(OH﹣)=c(H+)
D.当吸收液呈中性时,c(Na+)>c(HSO ![]() )+c(SO
)+c(SO ![]() )
)