题目内容
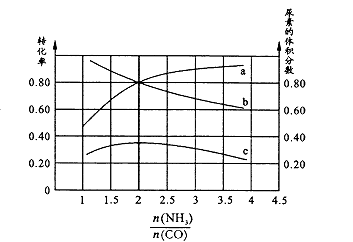
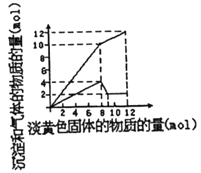
【题目】某溶液中可能合有Fe2+、Mg2+、Cu2+、NH4+、Al3+中的一种或几种。当加入一种淡黄色固体并加热时,有刺激性气体放出和白色沉定生成,加入淡黄色固体的物质的量(横坐标)与析出的沉淀和产生气体的物质的量(纵坐标)的关系如图所示。下列叙述错误的是
A. 溶液中一定含有的离子是NH4+、Al3+和Mg2+
B. 溶液中肯定不含有Cu2+,可能含有Fe2+
C. 所加的淡黄色固体是Na2O2
D. 溶液中的NH4+和Al3+的物质的量浓度之比3:1
【答案】B
【解析】A.淡黄色固体加入溶液中,并加热溶液时,有刺激性气体放出和白色沉淀生成,则淡黄色固体为Na2O2,图象实际为两个图合在一起,较上的是气体,较下的是沉淀,图象中加入8mol过氧化钠后,沉淀减小,且没有完全溶解,则溶液中一定没有Fe2+和Cu2+,一定有Mg2+、NH4+、Al3+,加入8mol过氧化钠之后,生成气体减小,故加入8mol过氧化钠时,铵根离子完全反应,A正确;B.根据以上分析可知B错误;C.根据以上分析可知C正确;D.根据图像可知溶解氢氧化铝消耗过氧化钠是1mol,1mol过氧化钠产生2mol氢氧化钠,根据Al(OH)3+OH-=AlO2-+2H2O可知氢氧化铝是2mol,所以铝离子是2mol。8mol过氧化钠产生4mol氧气,所以产生的氨气是10mol-4mol=6mol,则铵根是6mol,所以溶液中的NH4+和Al3+的物质的量浓度之比3:1,D正确,答案选B。

练习册系列答案
 春雨教育同步作文系列答案
春雨教育同步作文系列答案
相关题目