题目内容
【题目】有A、B、C、D、E五种原子序数依次增大的元素(原子序数均小于30).A的基态原子2p能级有3个单电子;C的基态原子2p能级有1个单电子;E原子最外层有1个单电子,其次外层有3个能级且均排满电子;D与E同周期,价电子数为2.则: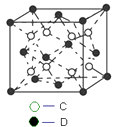
(1)B元素的氢化物的沸点是同族元素氢化物中最高的,原因是 .
(2)A、B、C三种元素的氢化物稳定性由强到弱的顺序为(用化学式表示).
(3)A的最简单氢化物分子的空间构型为 , 其中A原子的杂化类型是 .
(4)A的单质中δ键的个数为 , π键的个数为 .
(5)写出基态E原子的价电子排布式: .
(6)C和D形成的化合物的晶胞结构如图所示,已知晶体的密度为ρ gcm﹣3 , 阿伏加德罗常数为NA , 求晶胞边长a=cm.(用ρ、NA的计算式表示)
【答案】
(1)水分子间之间存在氢键,氢键比范德华力更强
(2)HF>H2O>NH3
(3)三角锥形;sp3
(4)1;2
(5)3d104s1
(6)![]()
【解析】解:A、B、C、D、E五种原子序数依次增大的元素(原子序数均小于30),A的基态原子2p能级有3个单电子,原子核外电子排布为1s22s22p3 , 则A是N元素;C的基态原子2p能级有1个单电子,且C的原子序数大于A,其原子核外电子排布为1s22s22p5 , 所以C是F元素,结合原子序数可推知B是O元素;E原子核外有成单电子,其次外层有3个能级且均排满电子,且原子序数小于30,则E处于第四周期,其基态原子的价电子排布式3d104s1 , 则E是Cu元素;D与E同周期,价电子数为2,则D是Ca元素.(1)水分子间能存在氢键,氢键比范德华力更强,H2O的沸点是同族元素中最高的,所以答案是:水分子间之间存在氢键,氢键比范德华力更强;(2)由于非金属性F>O>N,故氢化物稳定性:HF>H2O>NH3 ,
所以答案是:HF>H2O>NH3;(3)A的最简单氢化物为NH3 , 为三角锥形结构,分子中N原子形成3个N﹣H键,含有1对孤对电子,杂化轨道数目为4,故N原子采取sp3杂化,
所以答案是:三角锥形;sp3;(4)氮气的结构式为:N≡N,所以氮气分子中含有一个σ键两个π键,
所以答案是:1;2;(5)E是铜元素,根据构造原理知,其基态原子的核外电子排布式[Ar]3d104s1 , 故基态Cu原子的价电子排布式为:3d104s1 ,
所以答案是:3d104s1;(6)白色球为F、黑色球为Ca,由晶胞结构可知,晶胞中白色球数目=8、黑色球数目=8× ![]() +6×
+6× ![]() =4,则晶胞质量=4×
=4,则晶胞质量=4× ![]() g=
g= ![]() g,晶胞的体积=
g,晶胞的体积= ![]() g÷ρ gcm﹣3=
g÷ρ gcm﹣3= ![]() cm3 , 故晶胞边长a=
cm3 , 故晶胞边长a= ![]() cm,
cm,
所以答案是: ![]() .
.