题目内容
【题目】综合利用海水可以制备淡水、食盐、纯碱、溴等物质,其流程如图所示:
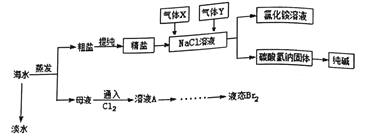
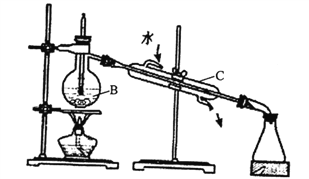
(1)实验室中可用下图装置从海水中获得淡水,B、C仪器的名称分别是B____________、C_________;B装置中如果忘加沸石,应_________;下图装置中有___________处错误。
(2)在母液中通入氯气可置换出单质溴,从溶液A 中提取Br2,需要的主要仪器是__________。
(3)粗盐中含有Na2SO4、MgCl2、CaCl2等可溶性杂质,为制得纯净的NaCl晶体,操作如下:
a、溶解;b、依次加入过量的_________溶液、NaOH 溶液、c、_________;d、加适量盐酸; e、___________ (请补全缺少的试剂和实验步骤)。
(4)实验室需要使用480mL0.1mol/L的该精制盐溶液,则配制该溶液时:
①需要用托盘天平称量氯化钠的质量____________ g。
②下列实验操作会使配制结果偏高的是_______。
A.砝码生锈了 B.定容时俯视刻度线
C.没洗涤烧杯和玻璃棒 D.容量瓶中残留少量蒸馏水
E.定容摇匀后,发现液面低于刻度线,又加少量蒸馏水至液面与刻度线相切
(5)向氯化钠溶液中先后通入的气体X、Y 的化学式分别为_________、____________,你认为先通气体X的原因是_______________,该反应的化学方程式为__________________。
(6)用这种方法制得的Na2CO3中有少量的NaCl。检验该Na2CO3中少量的NaCl的实验操作为_________。
【答案】 蒸馏烧瓶 冷凝管 停止加热,液体冷却后再加 3 分液漏斗 氯化钡溶液、碳酸钠溶液 过滤 蒸发 2.9 AB NH3 CO2 氨气溶解度大,易形成高浓度的碳酸氢根,便于生成的碳酸氢钠析出 NaCl+CO2+NH3+H2O=NaHCO3↓+NH4Cl 取适量固体溶于水,向其中加入过量的硝酸,再加硝酸银,有白色沉淀生成,说明有氯化钠
【解析】(1)根据仪器构造可判断B、C仪器的名称分别是蒸馏烧瓶、冷凝管;B装置中如果忘加沸石,应先停止加热,液体冷却后再加;根据装置图可知温度计水银球没有放在蒸馏烧瓶的支管出口处、没有垫石棉网加热、冷却水没有下口进,上口出,共计是3处错误。(2)在母液中通入氯气可置换出单质溴,从溶液A中提取Br2的操作是萃取后分液,需要的主要仪器是分液漏斗。(3)Ca2+用碳酸钠除去,Mg2+用氢氧化钠除去,SO42-用氯化钡除去,最后加入盐酸酸化。但由于过量的氯化钡要用碳酸钠来除,所以碳酸钠必需放在氯化钡的后面,而氢氧化钠可以随意调整。所以操作如下:a、溶解;b、依次加入过量的氯化钡溶液、碳酸钠溶液、NaOH溶液、c、过滤;d、加适量盐酸;e、蒸发。(4)①配制时需要500mL容量瓶,所以需要用托盘天平称量氯化钠的质量为0.5L×0.1mol/L×58.5g/mol≈2.9g。②A.砝码生锈了氯化钠的质量增加,浓度偏高;B.定容时俯视刻度线,溶液体积减少,浓度偏高;C.没洗涤烧杯和玻璃棒,溶质减少,浓度偏低;D.容量瓶中残留少量蒸馏水无影响;E.定容摇匀后,发现液面低于刻度线,又加少量蒸馏水至液面与刻度线相切,溶液体积增加,浓度偏低,答案选AB;(5)要产生碳酸氢钠固体和氯化铵溶液,需要通入氨气和二氧化碳,由于氨气溶解度大,易形成高浓度的碳酸氢根,便于生成的碳酸氢钠析出,所以首先通入的是氨气,该反应的化学方程式为NaCl+CO2+NH3+H2O=NaHCO3↓+NH4Cl。(6)检验该Na2CO3中少量的NaCl时只需要检验氯离子即可,所以实验操作为取适量固体溶于水,向其中加入过量的硝酸,再加硝酸银,有白色沉淀生成,说明有氯化钠。

【题目】(多选)等质量的铁与过量的盐酸在不同的实验条件下进行反应,测定在不同时间t产生气体体积V的数据,根据数据绘制得到如图,则曲线a、b、c、d所对应的实验组别可能是( )
组别 | c(HCl)(mol/L) | 温度(℃) | 状态 |
1 | 2.0 | 25 | 块状 |
2 | 2.5 | 30 | 块状 |
3 | 2.5 | 50 | 块状 |
4 | 2.5 | 30 | 粉末状 |
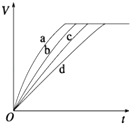
A.4﹣3﹣2﹣1
B.1﹣2﹣3﹣4
C.3﹣4﹣2﹣1
D.1﹣2﹣4﹣3

