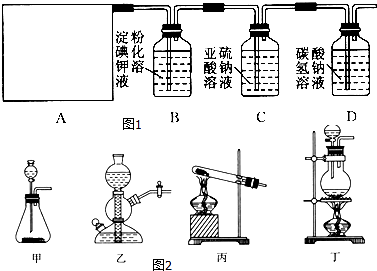
��Ŀ����
����Ŀ����ҵ����ƽ�VOSO4�е�K2SO4��SiO2���ʳ�ȥ�����յõ�V2O5���������£�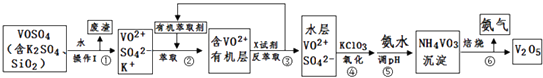
��ش��������⣺
��1����������÷����ijɷ�����д��ѧʽ��������I������ ��
��2������ڡ��۵ı仯���̿ɼ�Ϊ����ʽR��ʾVO2+ �� HA��ʾ�л���ȡ������R2��SO4��n ��ˮ�㣩+2nHA���л��㣩2RAn���л��㣩+nH2SO4 ��ˮ�㣩
������ȡʱ��������������ԭ���� ��
����X�Լ�Ϊ ��
��3���ݵ����ӷ���ʽΪ ��
��4��25��ʱ��ȡ����������������õ��������ʺ���ҺpH֮���ϵ���±���
pH | 1.3 | 1.4 | 1.5 | 1.6 | 1.7 | 1.8 | 1.9 | 2.0 | 2.1 |
��������% | 88.1 | 94.8 | 96.5 | 98.0 | 98.8 | 98.8 | 96.4 | 93.1 | 89.3 |
����ϱ�����ʵ�������У����м��백ˮ��������Һ�����pHΪ������������Ϊ93.1%ʱ������Fe��OH��3����������Һ��c��Fe3+���� ��
��5���ù��������У�����ѭ�����õ��������� ��
���𰸡�
��1��SiO2������
��2��������кͲ������ᣬƽ����������˷�����ȡ�ʣ�����
��3��NH3H2O+VO3���TNH4VO3��+OH��
��4��1.7��1.8��2.6��10��3mol/L
��5���л���ȡ��������
���������⣺��1���Ϸ���������Ҫ�ɷ�V2O5��Fe2O3��SiO2�ȣ����ܺ�V2O5��Fe2O3���ᷴӦ���������費���ᷴӦ�����˵õ�����Ϊ�������裬�ʴ�Ϊ��SiO2 �� ���ˣ���2��������ȡʱ����������������ƽ�⣬Rn+��ˮ�㣩+nHA���л��㣩RAn���л��㣩+nH+��ˮ�㣩������ļ���ƽ���е������ӷ�Ӧ�ٽ�ƽ��������У����з���ȡʱ�����X�Լ�������ƽ��������У����Լ�����������ƽ��������У�
�ʴ�Ϊ��������кͲ������ᣬƽ����������˷�����ȡ�ʣ������3����ˮ��VO3����Ӧ�����ӷ���ʽΪ��NH3H2O+VO3���TNH4VO3��+OH�� �� �ʴ�Ϊ��NH3H2O+VO3���TNH4VO3��+OH������4�����ݱ��������жϣ����м��백ˮ��������ҺpH���ֵΪ1.7��1.8����ʱ�������ʴﵽ�����Ҫ��ˮ����С������������Ϊ93.1%ʱ������Fe��OH��3��������ʱPH=2��c��H+��=10��2mol/L��c��OH����=10��12mol/L������Һ��c��Fe3+��Ũ�������ܶȻ����㣬Ksp[Fe��OH��3]=c��Fe3+����c3��OH����=2.6��10��39 �� ����õ�c��Fe3+��=2.6��10��3molL��1 �� ������Fe��OH��3����������Һ��c��Fe3+����2.6��10��3molL��1 ��
�ʴ�Ϊ��1.7��1.8��2.6��10��3����5����������ͼ�����ʲμӷ�Ӧ����Ӧ�����������ɵ����ʣ����ظ����õ����ʿ���ѭ�����ã��������л���ȡ������������ѭ�����ã��ʴ�Ϊ���л���ȡ����������
��1���Ϸ���������Ҫ�ɷ�V2O5��Fe2O3��SiO2�ȣ����ܺ������費���ᷴӦ�����˵õ�����Ϊ�������裻��2��������ȡʱ���������������ƽ���е������ӷ�Ӧ�ٽ�ƽ��������У����з���ȡʱ�����X�Լ�������ƽ��������У���3�����ݰ�ˮ��VO3����Ӧ��ƽ�õ����ӷ���ʽ����4�����ݱ��������жϣ����м��백ˮ��������ҺpH���ֵΪ1.8����ʱ�������ʴﵽ�����Ҫ��ˮ����С�����ݳ����ܶȻ������������5����������ͼ�����ʲμӷ�Ӧ����Ӧ�����������ɿ���ѭ�����ã�