题目内容
【题目】铁是重要的工业元素。
(1)铁元素位于周期表中的___________区,Fe的外围电子排布的轨道表示式为_____,Fe的7个能级中能量最高的是__________________。
(2)(NH4)2Fe(SO4)2·6H2O俗称摩尔盐,其中H2O的VSEPR模型名称为______________。写出一种与SO42-互为等电子体的分子的化学式__________________。
(3)金属Fe具有导电性,温度越高其导电性越____________,其原因是__________________。
(4)ZnCl2浓溶液常用于除去Fe表面的氧化物,反应可得[Zn(OH)2Cl2]2-溶液。[Zn(OH)2Cl2]2-中肯定不存在的微粒间作用力有_________________(填选项字母);
A.离子键 B.共价键 C.金属键 D.配位键 E.范德华力
画出溶液中[Zn(OH)2Cl2]2-的结构式,并表示出配位键____________________。
(5)某种磁性氮化铁的结构如图所示 ,Fe为____________堆积,N随机排列在Fe构成的正四面体空隙中,空隙的占有率为
,Fe为____________堆积,N随机排列在Fe构成的正四面体空隙中,空隙的占有率为![]() ,则该化合物的化学式为_____________。 其中铁原子最近的铁原子的个数为_________________;氮化铁晶胞底边长为a nm,高为c nm,则这种磁性氮化铁的晶体密度为__________g·cm-3(用含a、c和NA的计算式表示)。
,则该化合物的化学式为_____________。 其中铁原子最近的铁原子的个数为_________________;氮化铁晶胞底边长为a nm,高为c nm,则这种磁性氮化铁的晶体密度为__________g·cm-3(用含a、c和NA的计算式表示)。
【答案】 d ![]() 4s 四面体 SiF4(CCl4等) 差 温度升高,自由电子间碰撞加剧导致自由电子的定向移动能力变弱,导电性减小 A、C、E
4s 四面体 SiF4(CCl4等) 差 温度升高,自由电子间碰撞加剧导致自由电子的定向移动能力变弱,导电性减小 A、C、E 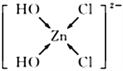 六方最密 Fe3N 12
六方最密 Fe3N 12 ![]()
【解析】(1)铁原子的核电荷数为26,核外电子排布为1s22S22p63s23p63d64s2,铁元素位于周期表中的d区,Fe的外围电子排布的轨道表示式为![]() ;Fe的7个能级中能量最高的是4s;正确答案:d;
;Fe的7个能级中能量最高的是4s;正确答案:d; ![]() ;4s。
;4s。
(2)水分子中价层电子对个数=2+1/2×(6-2×1)=4,VSEPR模型为四面体结构;等电子体是指原子总数相等,电子总数相等,SO42-中有原子5个,电子总数为50个,因此满足与之等电子体的分子有SiF4或CCl4等; 正确答案:四面体;SiF4(CCl4等)。
(3)对于金属来讲,温度升高,自由电子间碰撞加剧导致自由电子的定向移动能力变弱,导电性减小,因此 温度越高铁的导电性越差;正确答案:差;温度升高,自由电子间碰撞加剧导致自由电子的定向移动能力变弱,导电性减小。
(4)[Zn(OH)2Cl2]2-中存在共价键(O-H)、配位键(OH→Zn,Cl→Zn),不存在离子键、金属键和范德华力;OH、Cl与Zn形成4个配位键,结构式为: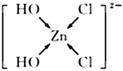 ;正确答案:A、C、E;
;正确答案:A、C、E; 。
。
(5)根据晶胞的结构,可知Fe为六方最密堆积;根据均摊法在氮化铁晶胞中,含有N原子数为2,Fe原子数为2×1/2+12×1/6+3=6,所以氮化铁的化学式Fe3N;其中铁原子最近的铁原子的个数为12;若晶胞底边长为a nm,高为c nm,则晶胞的体积是![]() ,所以这种磁性氮化铁的晶体密度为
,所以这种磁性氮化铁的晶体密度为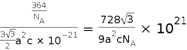 g/㎝3=
g/㎝3=![]() g/㎝3;正确答案:六方最密;Fe3N;12;
g/㎝3;正确答案:六方最密;Fe3N;12; ![]() 。
。

 阅读快车系列答案
阅读快车系列答案
