题目内容
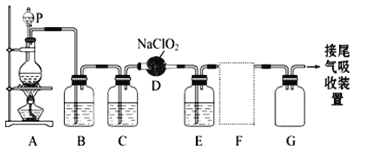
【题目】某研究性学习小组设计了如下装置制取和验证SO2的性质。

请回答:
(1)写出图中仪器的名称:a___________,b___________。
(2)棉球中NaOH溶液的作用是______________________。
(3)为了验证SO2是酸性氧化物,洗气瓶②中可选择的试剂是_____________________。
A.紫色石蕊试液 B.无色酚酞试液 C.澄清石灰水 D.碘水
(4)下列说法正确的是____________。
A.实验开始时,只需打开分液漏斗的旋塞,即可使液体顺利滴下
B.先向装置中加入试剂(药品),再进行气密性检查
C.实验开始后,洗气瓶①和③只溶液均褪色,两者均可证明SO2具有漂白性
D.实验开始后,洗气瓶④中可观察到白色沉淀产生,该现象可说明SO2具有还原性
(5)洗气瓶④中发生反应的离子方程式为________________________。
【答案】 分液漏斗 干燥管 吸收尾气,防止SO2污染大气 AC D SO2+2Fe3++Ba2++2H2O=BaSO4↓+2Fe2++4H+或写出SO2+2Fe3++2H2O=SO42-+2Fe2++4H+;Ba2++SO42-=BaSO4↓
【解析】(1)由装置图可知仪器a的名称为分液漏斗,仪器b的名称为干燥管;
(2)干燥管在装置最后,其中棉球上蘸有NaOH溶液,其作用是吸收有害尾气SO2,防止污染空气;
(3)A、酸性氧化物可与水反应生成相应的酸,所以要验证SO2是酸性氧化物,可验证其水溶液是否显酸性,因此可在洗气瓶②中盛放紫色石蕊试液,则A正确;B、酸与酚酞不变色,所以B错误;C、酸性氧化物能与碱反应生成盐和水,故要验证SO2是酸性氧化物,也可在洗气瓶②中盛放澄清石灰水,所以C正确;D、碘水与SO2反应而褪色,但表现的是SO2的还原性,故D错误。因此正确答案为AC;
(3)A、实验开始时,要先打开分液漏斗上口的塞子,再打开分液漏斗的旋塞,液体才能顺利滴下,故错误;B、装置的气密性检查是在装药品之前进行的,故B 错误;C、实验开始后,洗气瓶①中的品红溶液褪色,证明SO2具有漂白性,而洗气瓶③中的溴水褪色,能证明SO2具有还原性,所以C错误;D、洗气瓶④中的FeCl3具有较强的氧化性,可将SO2氧化为SO42—,再与Ba2+反应生成白色沉淀,所以该现象说明SO2具有还原性,故D正确。因此正确答案为D;
(4)洗气瓶④中发生反应的离子方程式为SO2+2Fe3++Ba2++2H2O=BaSO4↓+2Fe2++4H+(或写出SO2+2Fe3++2H2O=SO42-+2Fe2++4H+;Ba2++SO42-=BaSO4↓)。

 一课一练课时达标系列答案
一课一练课时达标系列答案 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案【题目】根据题意解答
(1)CH3﹣CH3(g)→CH2=CH2(g)+H2(g);有关化学键的键能如下.
化学键 | C﹣H | C=C | C﹣C | H﹣H |
键能(kJ/mol) | 414.4 | 615.3 | 347.4 | 435.3 |
试计算该反应的反应热△H= .
(2)白磷与氧可发生如下反应:P4(S)+5O2(g)=P4O10(S) . 已知断裂下列化学键需要吸收的能量分别为如下
化学键 | P﹣P | P﹣O | P=O | O﹣O | O=O |
键能(kJ/mol) | a | b | c | d | e |
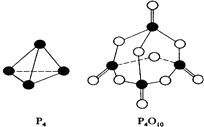
根据图示的分子结构和有关数据估算该反应的△H=;
(3)肼可作为火箭发动机的燃料,与氧化剂N2O4反应生成N2和水蒸气. 已知:①N2(g)+2O2(g)=N2O4(1)△H1=﹣195.0kJmol﹣1
②N2H4(1)+O2(g)=N2(g)+2H2O(g)△H2=﹣534.2kJmol﹣1
写出肼和N2O4反应的热化学方程式 .
【题目】碘在科研与生活中有重要应用.某兴趣小组用0.50molL﹣1KI、0.2%淀粉溶液、0.20molL﹣1K2S2O8、0.10molL﹣1Na2S2O3等试剂,探究反应条件对化学反应速率的影响.已知: S2O82﹣+2I﹣═2SO42﹣+I2(慢) I2+2S2O32﹣═2I﹣+S4O62﹣(快)
(1)向KI,Na2S2O3与淀粉的混合溶液中加入一定量的K2S2O8溶液,当溶液中的耗尽后,溶液颜色将由无色变成为蓝色.其中该反应速率快慢的是由(填“第一个”或“第二个”)反应决定的.为确保能观察到蓝色,S2O32﹣与S2O82﹣初始的物质的量需满足的关系为:n(S2O32﹣):n(S2O82﹣) .
(2)为探讨反应物浓度对化学反应速率的影响,设计的实验方案如下表:
实验序号 | 体积/mL溶液 | ||||
K2S2O8溶液 | H2O | KI溶液 | Na2S2O3溶液 | 淀粉溶液 | |
① | 10.0 | 0.0 | 4.0 | 4.0 | 2.0 |
② | 9.0 | V1 | V3 | 4.0 | 2.0 |
③ | 8.0 | V2 | V4 | V5 | 2.0 |
表中V3、V4和V5取实验设计的体积数值,目的是 , 表中的V2= , 理由是 .