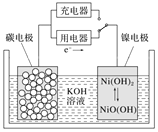
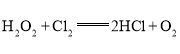题目内容
【题目】如图是实验室制备氯气并进行一系列相关实验的装置(夹持及加热仪器已略)。
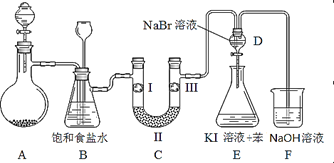
(1)制备氯气选用的药品为固体二氧化锰和浓盐酸,则相关的化学反应方程式为:_____________。装置B中饱和食盐水的作用是_____________;同时装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象 _____________________________。
(2)装置C的实验目的是验证氯气是否具有漂白性,为此C中I、II、III依次放入_______。(填字母序号)
a | b | c | d | |
I | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
II | 碱石灰 | 硅胶 | 浓硫酸 | 无水氯化钙 |
III | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
(3)设计装置D、E的目的是比较氯、溴、碘单质的氧化性强弱。当向D中缓缓通入少量氯气时,可以看到无色溶液逐渐变为__________色,说明_________________________。
打开活塞,将装置D中少量溶液加入装置E中,振荡。观察到的现象是 _______________,写出反应的化学方程式是_________________________。
(4)装置F中用足量的NaOH溶液吸收余氯,试写出相应的离子方程式:____________
【答案】MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O 除去Cl2中混有的HCl B中长颈漏斗中有水柱上升 d 橙 氯单质的氧化性比溴强 液体分为两层,上层液体显紫红色 Cl2 + 2NaBr=2NaCl + Br2、Br2 + 2KI=2KBr+ I2 Cl2+2OH-=Cl-+ClO-+H2O
MnCl2+Cl2↑+2H2O 除去Cl2中混有的HCl B中长颈漏斗中有水柱上升 d 橙 氯单质的氧化性比溴强 液体分为两层,上层液体显紫红色 Cl2 + 2NaBr=2NaCl + Br2、Br2 + 2KI=2KBr+ I2 Cl2+2OH-=Cl-+ClO-+H2O
【解析】
(1)二氧化锰与浓盐酸反应生成氯化锰、氯气和水;制取的氯气中含有氯化氢杂质,结合装置中气体压强变化分析现象;
(2)验证氯气是否具有漂白性,要验证干燥氯气无漂白性,湿润的有色布条中氯气和水反应生成次氯酸具有漂白性;
(3)氯气的氧化性强于溴,溴的氧化性强于碘,据此分析解答;
(4)氯气与氢氧化钠反应生成氯化钠、次氯酸钠和水。
(1)二氧化锰与浓盐酸加热反应生成氯化锰、氯气和水,反应的化学方程式为:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O;制取的氯气中含有氯化氢杂质,氯化氢易溶于水,氯气在饱和食盐水中溶解度不大,选择饱和食盐水吸收氯气中的氯化氢,装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,发生堵塞时B中气体的压强增大,B中长颈漏斗中液面上升,形成水柱,故答案为:MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O;制取的氯气中含有氯化氢杂质,氯化氢易溶于水,氯气在饱和食盐水中溶解度不大,选择饱和食盐水吸收氯气中的氯化氢,装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,发生堵塞时B中气体的压强增大,B中长颈漏斗中液面上升,形成水柱,故答案为:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O;除去Cl2中混有的HCl;B中长颈漏斗中有水柱上升;
MnCl2+Cl2↑+2H2O;除去Cl2中混有的HCl;B中长颈漏斗中有水柱上升;
(2)装置C的实验目的是验证氯气是否具有漂白性,实验事实是干燥氯气无漂白性,湿润的有色布条中,氯气和水反应生成次氯酸具有漂白性。选项中的Ⅱ都是干燥剂,要验证氯气不具有漂白性,需要干燥的氯气和干燥的有色布条,所以C中I、II、III依次放入湿润的有色布条、无水氯化钙、干燥的有色布条,所以选d,故答案为:d;
(3)设计装置D、E的目的是比较氯、溴、碘单质的氧化性强弱,因此D中是溴化钠,当向D中缓缓通入少量氯气时,氯气和溴化钠反应生成溴单质,Cl2 + 2NaBr=2NaCl + Br2,可以看到无色溶液逐渐变为橙色,打开活塞,将装置D中少量溶液加入装置E中,溴将KI溶液中的碘置换出来,Br2 + 2KI=2KBr+ I2,溶液从无色变化为黄色,碘易溶于苯,苯不溶于水,振荡,苯层呈现紫红色,故答案为:橙;氯单质的氧化性比溴强;液体分为两层,上层液体显紫红色;Cl2 + 2NaBr=2NaCl + Br2、Br2 + 2KI=2KBr+ I2;
(4)氯气有毒,直接排放容易造成空气污染,氯气与氢氧化钠反应生成氯化钠、次氯酸钠和水,可以被氢氧化钠吸收,反应的离子方程式:Cl2+2OH-=Cl-+ClO-+H2O,故答案为:Cl2+2OH-=Cl-+ClO-+H2O。