题目内容
【题目】KMnO4(s)受热分解制备氧气是实验室制氧气的常用方法,它也是一种高效氧化剂,是氧化还原滴定实验中常用的试剂,可以作为标准溶液滴定一些具有还原性的物质(Fe2+、C2O42-等)的溶液,如5C2O42-+2MnO4-+l6H++4H2O=2[Mn(H2O)6]2++10CO2↑。
(1)基态Mn2+的核外电排布式为___。
(2)如果在空气中焙烧KMnO4,可获得Mn3O4(可改写为MnOMn2O3),则Mn3O4中Mn的化合价为___。
(3)石墨烯(如图A)是一种由碳原子组成六边形呈蜂巢晶格的二维碳纳米材料,当石墨烯中部分碳原子被氧化后,其平面结构会发生改变,转化为氧化石墨烯(如图B)。
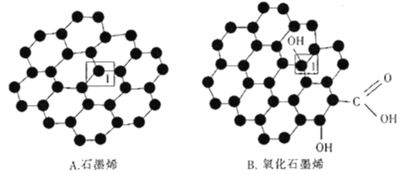
石墨烯结构中1号C的杂化方式为___;该C与相邻的两个C形成的键角___(填“>”“<”“=”)l20。氧化石墨烯结构中1号C与相邻C___(填“有”或“没有”)形成π键。
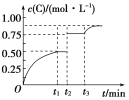
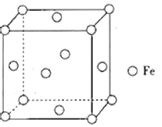
(4)铁形成的晶体类型因为铁原子排列方式的不同而不同,其中一种晶胞结构如图所示。晶体中铁原子周围距离最近且等距的铁原子数为___。形成铁碳合金时,存在一种碳原子插入到晶胞中每条棱的中点和晶胞的体心的结构,该物质的化学式为___;设NA为阿伏加德罗常数的值,该铁碳晶胞的晶胞参数为apm,则C原子间的最短距离为______pm,该铁碳晶胞的密度为___ gcm-3。
【答案】1s22s22p63s23p63d5 +2、+3 sp2 = 没有 12 FeC ![]()
![]()
【解析】
(1)~(3)可先写出Mn的电子排布式,然后写出Mn2+的电子排布式,或利用Fe2+进行类推;把Mn3O4改写为MnOMn2O3,利用各化合物中元素的化合价关系,确定Mn元素的化合价。由图形中原子的价电子排布,确定C原子发生的杂化,便可确定键角及键型。
(4)由铁原子所在位置,可确定晶体中铁原子周围距离最近且等距的铁原子,都是位于某个顶点Fe周围面心上的Fe原子;由Fe、C原子所在位置,可确定晶胞中所含Fe、C原子的个数,从而确定最简整数比,最终确定化学式;碳原子间的最短距离,应为一个面上棱中点连线,即等边直角三角形的斜边。一个晶胞的质量除以一个晶胞的体积,便得晶胞的密度。
(1)基态Mn的核外电子排布式为1s22s22p63s23p63d54s2,则Mn2+的核外电排布式为1s22s22p63s23p63d5。答案为:1s22s22p63s23p63d5;
(2)将Mn3O4改写为MnOMn2O3,MnO中Mn显+2价,Mn2O3中Mn显+3价,则Mn3O4中Mn的化合价为+2、+3。答案为:+2、+3;
(3)石墨烯结构中1号C的价层电子对数为3,杂化方式为sp2;该C与相邻的两个C形成平面正三角形,键角=l20。氧化石墨烯结构中1号C与相邻4个C形成共价键,即发生sp3杂化,所以没有形成π键。答案为:sp2;=;没有;
(4)晶体中铁原子位于晶胞的顶点和面心,顶点Fe原子所属三个面的面心上的Fe原子与它距离最近且等距,则铁原子数为![]() =12。形成铁碳合金时,存在一种碳原子插入到晶胞中每条棱的中点和晶胞的体心的结构,该晶胞中所含Fe原子数为8×
=12。形成铁碳合金时,存在一种碳原子插入到晶胞中每条棱的中点和晶胞的体心的结构,该晶胞中所含Fe原子数为8×![]() +6×
+6×![]() =4,所含C原子数为12×
=4,所含C原子数为12×![]() +1=4,Fe、C原子个数为1:1,所以该物质的化学式为FeC。由前面分析知,C原子间的最短距离为同一面上两条边的中点连线,即构成等腰直角三角形,直角边长为
+1=4,Fe、C原子个数为1:1,所以该物质的化学式为FeC。由前面分析知,C原子间的最短距离为同一面上两条边的中点连线,即构成等腰直角三角形,直角边长为![]() pm,C原子间的最短距离为斜边边长,即为
pm,C原子间的最短距离为斜边边长,即为![]() pm,该铁碳晶胞的密度为
pm,该铁碳晶胞的密度为![]() =
=![]() gcm-3。答案为:12;FeC;
gcm-3。答案为:12;FeC;![]() ;
;![]() 。
。

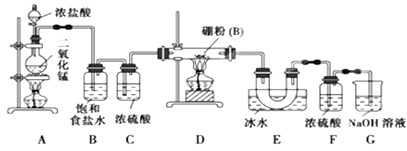
【题目】如图是实验室制备氯气并进行一系列相关实验的装置(夹持及加热仪器已略)。
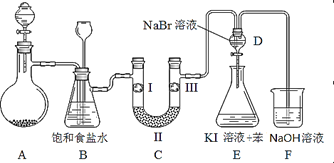
(1)制备氯气选用的药品为固体二氧化锰和浓盐酸,则相关的化学反应方程式为:_____________。装置B中饱和食盐水的作用是_____________;同时装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象 _____________________________。
(2)装置C的实验目的是验证氯气是否具有漂白性,为此C中I、II、III依次放入_______。(填字母序号)
a | b | c | d | |
I | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
II | 碱石灰 | 硅胶 | 浓硫酸 | 无水氯化钙 |
III | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
(3)设计装置D、E的目的是比较氯、溴、碘单质的氧化性强弱。当向D中缓缓通入少量氯气时,可以看到无色溶液逐渐变为__________色,说明_________________________。
打开活塞,将装置D中少量溶液加入装置E中,振荡。观察到的现象是 _______________,写出反应的化学方程式是_________________________。
(4)装置F中用足量的NaOH溶液吸收余氯,试写出相应的离子方程式:____________