题目内容
【题目】NA为阿伏加德罗常数的值。下列说法正确的是
A.50mL18.4mol·L-1浓硫酸与足量铜微热反应,生成SO2分子的数目为0.46NA
B.含NA个Na+的Na2O溶解于1L水中,所得溶液中Na+的物质的量浓度为1mol·L-1
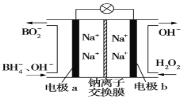
C.在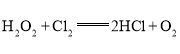 反应中,每生成32g氧气,则转移2NA个电子
反应中,每生成32g氧气,则转移2NA个电子
D.常温下,1L0.50mol·L-1NH4Cl溶液与2L0.25mol·L-1NH4Cl溶液所含![]() 物质的量相同
物质的量相同
【答案】C
【解析】
A.n(H2SO4)=18.4mol·L-1×50mL×10-3=0.92mol,假设H2SO4完全反应,则由![]() 可知,生成SO2的物质的量=
可知,生成SO2的物质的量=![]() =0.46mol,即生成SO2分子的数目为0.46NA,但是,随着反应的进行,H2SO4的浓度降低变为稀硫酸,稀硫酸不能发生上述反应,故生成SO2分子的数目小于0.46NA,A错误;
=0.46mol,即生成SO2分子的数目为0.46NA,但是,随着反应的进行,H2SO4的浓度降低变为稀硫酸,稀硫酸不能发生上述反应,故生成SO2分子的数目小于0.46NA,A错误;
B.Na2O+H2O=2NaOH,所得溶液中,n(Na+)=1mol,溶液体积未知,不能计算Na+的物质的量浓度,B错误;
C.由![]() 可知,每生成1molO2转移2mol电子,即每生成32g氧气,则转移2NA个电子,C正确;
可知,每生成1molO2转移2mol电子,即每生成32g氧气,则转移2NA个电子,C正确;
D.1L0.50mol·L-1NH4Cl溶液与2L0.25mol·L-1NH4Cl溶液的n(NH4Cl)相等,但是二者浓度不同,NH4+水解程度不同,故二者所含![]() 物质的量不相同,D错误。
物质的量不相同,D错误。
答案选C。

 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案【题目】如图是实验室制备氯气并进行一系列相关实验的装置(夹持及加热仪器已略)。
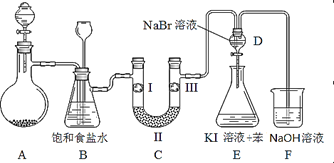
(1)制备氯气选用的药品为固体二氧化锰和浓盐酸,则相关的化学反应方程式为:_____________。装置B中饱和食盐水的作用是_____________;同时装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象 _____________________________。
(2)装置C的实验目的是验证氯气是否具有漂白性,为此C中I、II、III依次放入_______。(填字母序号)
a | b | c | d | |
I | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
II | 碱石灰 | 硅胶 | 浓硫酸 | 无水氯化钙 |
III | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
(3)设计装置D、E的目的是比较氯、溴、碘单质的氧化性强弱。当向D中缓缓通入少量氯气时,可以看到无色溶液逐渐变为__________色,说明_________________________。
打开活塞,将装置D中少量溶液加入装置E中,振荡。观察到的现象是 _______________,写出反应的化学方程式是_________________________。
(4)装置F中用足量的NaOH溶液吸收余氯,试写出相应的离子方程式:____________