题目内容
【题目】用吸附了氢气的纳米碳管等材料制作的二次电池原理如图所示,下列说法正确的是( )
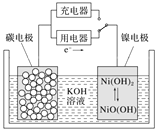
A.放电时,OH-移向镍电极
B.放电时,负极的电极反应为H2-2e-+2OH-=2H2O
C.充电时,将电池的碳电极与外电源的正极相连
D.充电时,阴极附近的pH减小
【答案】B
【解析】
开关连接用电器时,应为原电池原理,则根据电子流向,镍电极为正极,得电子发生还原反应;开关连接充电器时,为电解池,镍电极为阳极,失电子,发生氧化反应,Ni电极的电极反应Ni(OH)2+OH--e-=NiO(OH)+H2O。
A.放电时,该电池为原电池,碳电极为负极,镍电极为正极,电解质溶液中阴离子向负极移动,所以OH-移向碳电极,A错误;
B.放电时,碳电极为负极,负极上氢气失电子发生氧化反应,电极反应式为H2-2e-+2OH-=2H2O,B正确;
C.该电池充电时,为电解池,碳电极为阴极,碳电极附近物质要恢复原状,则应该得电子发生还原反应,所以碳电极作阴极,应该与电源的负极相连,C错误;
D.充电时,阴极上H2O电离产生的H+得到电子变为H2,电极反应式为2H2O+2e-=H2↑+2OH-,破坏了附近水的电离平衡,最终达到平衡时附近溶液中c(OH-)增大,溶液的碱性增强,pH增大,D错误;
故合理选项是B。

【题目】如图是实验室制备氯气并进行一系列相关实验的装置(夹持及加热仪器已略)。

(1)制备氯气选用的药品为固体二氧化锰和浓盐酸,则相关的化学反应方程式为:_____________。装置B中饱和食盐水的作用是_____________;同时装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象 _____________________________。
(2)装置C的实验目的是验证氯气是否具有漂白性,为此C中I、II、III依次放入_______。(填字母序号)
a | b | c | d | |
I | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
II | 碱石灰 | 硅胶 | 浓硫酸 | 无水氯化钙 |
III | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
(3)设计装置D、E的目的是比较氯、溴、碘单质的氧化性强弱。当向D中缓缓通入少量氯气时,可以看到无色溶液逐渐变为__________色,说明_________________________。
打开活塞,将装置D中少量溶液加入装置E中,振荡。观察到的现象是 _______________,写出反应的化学方程式是_________________________。
(4)装置F中用足量的NaOH溶液吸收余氯,试写出相应的离子方程式:____________
【题目】某研究小组在电压为24V时进行如下实验,电解3分钟后,发现下列现象。
编号 | ① | ② | ③ |
装置 |
|
|
|
现象 | 小灯泡微弱发光,两极均产生气泡,阳极附近出现白色浑浊,阴极附近无明显变化 | 两极均产生气泡,溶液无明显变化 | 两极均产生气泡,阳极附近出现白色浑浊,阴极附近无明显变化 |
下列说法正确的是( )
A.①中小灯泡微亮是因为Ca(OH)2是弱电解质
B.对比①和②,白色浑浊的出现与电极材料无关
C.对比①和③,白色浑浊是由于OH-迁移到阳极使Ca(OH)2沉淀析出
D.阳极附近白色沉淀的成分可能是CaCO3