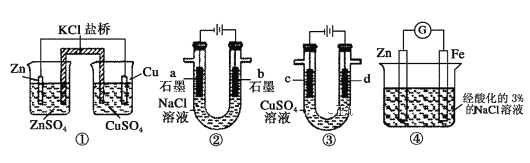
题目内容
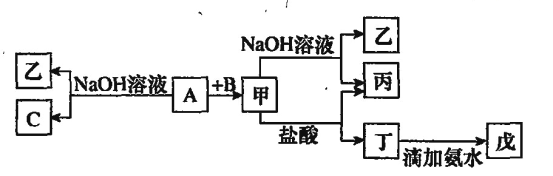
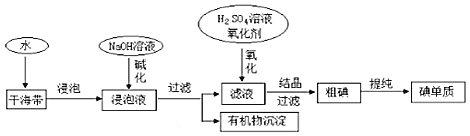
【题目】如图为从海带中提取碘的工业生产过程,有关说法错误的是()
A.在实验室进行氧化操作时,加入的氧化剂可以是新制氯水、双氧水等
B.碱化操作时,加入NaOH溶液的原因是在碱性溶液中,可溶性有机质可形成沉淀
C.因海水中蕴藏着极其丰富的碘元素,所以工业上也可以直接用海水来提取碘
D.在实验室进行过滤操作时,需要用到玻璃仪器有玻璃棒、烧杯、漏斗
【答案】C
【解析】
由流程可知,干海带浸泡后,用NaOH碱化,过滤分离出沉淀,滤液中酸化时碘离子被氧化生成碘单质,结晶、过滤分离出粗碘,碘容易升华,升华可提纯碘单质,据此分析解答。
A.新制氯水、双氧水等均可氧化碘离子,故A正确;
B.由图可知,过滤分离出有机物沉淀,则碱化操作时,加入NaOH溶液的原因是在碱性溶液中,可溶性有机质可形成沉淀,故B正确;
C.海水中蕴藏着极其丰富的碘元素,但海水中碘离子浓度较低,应浓缩后提取,故C错误;
D.过滤需要玻璃棒、烧杯、漏斗,故D正确;
故选C。

 导学教程高中新课标系列答案
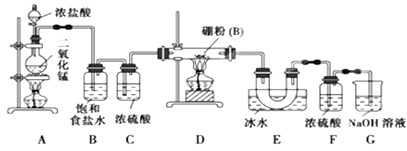
导学教程高中新课标系列答案【题目】如图是实验室制备氯气并进行一系列相关实验的装置(夹持及加热仪器已略)。
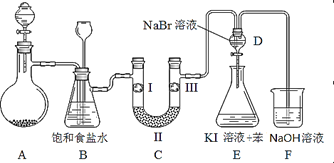
(1)制备氯气选用的药品为固体二氧化锰和浓盐酸,则相关的化学反应方程式为:_____________。装置B中饱和食盐水的作用是_____________;同时装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象 _____________________________。
(2)装置C的实验目的是验证氯气是否具有漂白性,为此C中I、II、III依次放入_______。(填字母序号)
a | b | c | d | |
I | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
II | 碱石灰 | 硅胶 | 浓硫酸 | 无水氯化钙 |
III | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
(3)设计装置D、E的目的是比较氯、溴、碘单质的氧化性强弱。当向D中缓缓通入少量氯气时,可以看到无色溶液逐渐变为__________色,说明_________________________。
打开活塞,将装置D中少量溶液加入装置E中,振荡。观察到的现象是 _______________,写出反应的化学方程式是_________________________。
(4)装置F中用足量的NaOH溶液吸收余氯,试写出相应的离子方程式:____________