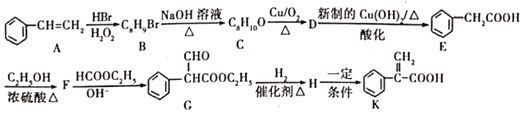
题目内容
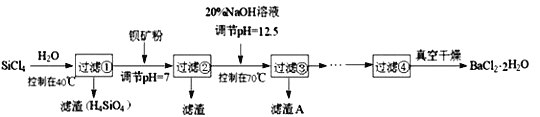
【题目】多晶硅(硅单质的一种)被称为“微电子大厦的基石”,制备中副产物以SiCl4为主,它对环境污染很大,遇水能强烈水解,放出大量的热。研究人员利用SiCl4水解生成的盐酸和钡矿粉(主要成分为BaCO3,且含有铁、镁等离子),制备BaCl2·2H2O,工艺流程如下:
已知:
① 常温下Fe3+、Mg2+完全沉淀的pH分别是3.4、12.4;
② BaCO3的相对分子质量是197;BaCl2·2H2O的相对分子质量是244。
回答下列问题:
(1)SiCl4发生水解反应的化学方程式为______________________________________________
(2)用H2还原SiCl4蒸气可制取纯度很高的硅,当反应中有1 mol电子转移时吸收59 kJ热量,则该反应的热化学方程式为__________________________________________________________
(3)加钡矿粉并调节pH=7的目的是①______________________,②______________________
(4)过滤②后的滤液中Fe3+浓度为_______________(滤液温度25℃,Ksp[Fe(OH)3]=2.2×10-38)。
(5)生成滤渣A的离子方程式________________________________________
(6)BaCl2滤液经___________、__________、过滤、洗涤,再经真空干燥后得到BaCl2·2H2O
【答案】SiCl4+4H2O==H4SiO4↓+4HCl SiCl4(g)+2H2(g)==Si(s)+4HCl(g) ΔH=+236 kJ·mol-1 使BaCO3转化为BaCl2 使Fe3+完全沉淀 2.2×10-17mol·L-1 Mg2++2OH-====Mg(OH)2↓ 蒸发浓缩 冷却结晶
【解析】
根据工艺流程图分析每步操作发生的反应;根据Ksp的表达式计算溶液中的离子浓度。
(1)SiCl4发生水解反应生成难溶的原硅酸,化学方程式为:SiCl4+4H2O=H4SiO4↓+4HCl;
故答案为:SiCl4+4H2O=H4SiO4↓+4HCl;
(2)1molSiCl4被还原成Si时转移4mol电子,所以吸收的热量为:59 kJ×4=236 kJ,所以热化学方程式为:SiCl4(s)+2H2(g)=Si(s)+4HCl(g) △H=+236kJ/mol;
故答案为:SiCl4(s)+2H2(g)=Si(s)+4HCl(g) △H=+236kJ/mol;
(3)钡矿粉的主要成分是BaCO3,滤液呈酸性,反应生成氯化钡,根据题干信息可知pH=7时,Fe3+完全沉淀;
故答案为:使BaCO3转化为BaCl2;使Fe3+完全沉淀;
(4) pH=7时,c(OH-)=10-7mol/L,Ksp[Fe(OH)3]= c3(OH-) c(Fe3+)=2.2×10-38,则c(Fe3+)=2.2×10-17mol·L-1;
故答案为:2.2×10-17mol·L-1;
(5)由流程图知当pH=12.5时,Mg2+完全沉淀,所以滤渣A是Mg(OH)2,反应方程式为:Mg2++2OH-=Mg(OH)2↓;
故答案为:Mg2++2OH-=Mg(OH)2↓;
(6)BaCl2滤液经蒸发浓缩,冷却结晶,过滤,洗涤再真空干燥后得到BaCl2.2H2O;
故答案为:蒸发浓缩、冷却结晶。

【题目】氢化热是指一定条件下,lmol不饱和化合物加氢时放出的热量。表中是环己烯(![]() ),环己二烯(
),环己二烯(![]() )和苯的氢化热数据:
)和苯的氢化热数据:
物质 |
|
|
|
氢化热(kJ·mol-1) | ﹣119.7 | ﹣232.7 | ﹣208.4 |
根据表中数据推断正确的是( )
A.环己烯、环己二烯和苯分别跟氢气反应,环己二烯跟氢气反应最剧烈
B.环己烯、环己二烯和苯都含有相同的官能团
C.环己烯、环己二烯和苯相比较,苯最稳定
D.上述条件下,lmol![]() 转变为
转变为![]() 时吸收热量
时吸收热量