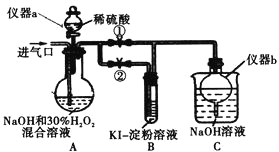
题目内容
【题目】工业上用钛白渣[主要成分为FeSO4,还含有少量Fe2(SO4)3、MgSO4及TiOSO4]为主要原料生产氧化铁黄(FeOOH)的一种工艺流程如下:
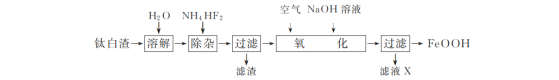
(1)“溶解”时,TiOSO4发生水解生成难溶于水的H2TiO3,反应的化学方程式为________。
(2)“除杂”时,加入NH4HF2固体的作用是________。
(3)“氧化”时,Fe2+生成FeOOH的离子方程式是________。
(4)滤液X中主要含有的阳离子是________(填化学式)。
(5)实验测得反应溶液的pH、温度对氧化铁黄产率的影响如图所示。
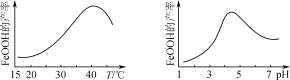
①反应温度宜选择________。
②氧化时应控制pH的合理范围是4.5左右,pH过小或过大均会导致氧化铁黄产率较低,其可能原因是__________________________________。
【答案】TiOSO4+2H2O=H2TiO3↓+H2SO4 除去Mg2+ 4Fe2++O2+8OH-=4FeOOH↓+2H2O Na+、NH4+ 40 ℃ pH过低导致氧化铁黄部分溶于酸,pH过大导致Fe(OH)3增多
【解析】
(1)TiOSO4水解生成难溶于水的H2TiO3和硫酸;
(2)NH4+水解使溶液显弱碱性;
(3)碱性条件下Fe2+与空气中的氧气结合生成FeOOH;
(4)向溶解的钛白渣中加入NH4HF2固体,除去了Mg2+,向过滤后的溶液中加入氢氧化钠溶液并通入空气,除去了铁元素,此时判断滤液中的阳离子;
(5)根据温度与FeOOH产率的示意图可确定反应的适宜温度;溶液酸性过强FeOOH部分溶解,碱性过强,Fe(OH)3增多。
(1)TiOSO4水解生成难溶于水的H2TiO3和硫酸,反应方程式为:TiOSO4+2H2O=H2TiO3↓+H2SO4;
(2)NH4+水解使溶液显弱碱性,Mg2+能与OH-结合生成沉淀,从而可除去Mg2+;
(3)碱性条件下Fe2+与空气中的氧气结合生成FeOOH,离子方程式为:4Fe2++O2+8OH-=4FeOOH↓+2H2O;
(4)向溶解的钛白渣中加入NH4HF2固体,除去了Mg2+,向过滤后的溶液中加入氢氧化钠溶液并通入空气,除去了铁元素,此时溶液中存在的阳离子是NH4+和Na+;
(5)根据温度与FeOOH产率的示意图可知40℃时FeOOH的产率最大,因此反应的适宜温度为40℃;由pH与FeOOH产率的示意图可知,当pH约4.5时FeOOH的产率最大,pH过低导致氧化铁黄部分溶于酸,pH过大导致Fe(OH)3增多。

【题目】下列实验中的现象,与氧化还原反应无关的是
A | B | C | D | |
实验 | 酒精溶液滴入高锰酸钾溶液中 | 石蕊溶液滴入氯水中 |
| 常温下,铝片插入浓硫酸中 |
现象 | 高锰酸钾溶液褪色 | 溶液变红,随后迅速褪色 | 沉淀由黄色逐渐变为黑色 | 无明显现象 |
A.AB.BC.CD.D