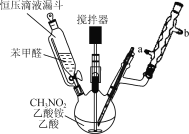
题目内容
【题目】已知下列反应的反应热:
(1)CH3COOH(l) + 2O2(g) = 2CO2(g) + 2H2O(l) △ H1 = 870.3 kJ · mol1
(2)C(s) + O2(g) = CO2(g) △ H2 = 393.5 kJ · mol1
(3)H2(g) + O2(g) = H2O(l) △ H3 = 285.8 kJ · mol1
则下列反应的反应热为( )2C(s) + 2H2(g) + O2(g) = CH3COOH(l)
A.△ H =+ 488.3 kJ · mol1B.△ H = 244.15 kJ · mol1
C.△ H = 977.6 kJ · mol1D.△ H = 488.3 kJ · mol1
【答案】D
【解析】
由(1)CH3COOH(l)+2O2(g)═2CO2(g)+2H2O(l)△H1=-870.3kJmol-1,(2)C(s)+O2(g)═CO2(g)△H2=-393.5kJmol-1,(3)H2(g)+![]() O2(g)═H2O(l)△H3=-285.8kJmol-1,由盖斯定律可知,(3)×2+(2)×2-(1)可得反应2C(s)+2H2(g)+O2(g)=CH3COOH(1),其反应热为2×(-285.8kJmol-1)+2×(-393.5kJmol-1)+870.3kJmol-1=-488.3kJmol-1,故答案为D。
O2(g)═H2O(l)△H3=-285.8kJmol-1,由盖斯定律可知,(3)×2+(2)×2-(1)可得反应2C(s)+2H2(g)+O2(g)=CH3COOH(1),其反应热为2×(-285.8kJmol-1)+2×(-393.5kJmol-1)+870.3kJmol-1=-488.3kJmol-1,故答案为D。

【题目】2.3g乙醇和一定量的氧气混合点燃,恰好完全燃烧,放出热量为68.35kJ。
(1)该反应的热化学方程式为___。
(2)已知:
化学键 | Si-Cl | H-H | H-Cl | Si-Si |
键能/kJ·mol-1 | 360 | 436 | 431 | 176 |
且硅晶体中每个硅原子和其他4个硅原子形成4个共价键。
工业上所用的高纯硅可通过下列反应制取:SiCl4(g)+2H2(g)![]() Si(s)+4HCl(g),该反应的反应热为___kJ·mol-1。
Si(s)+4HCl(g),该反应的反应热为___kJ·mol-1。
(3)已知水的比热容为4.2×10-3kJ·g-1·℃-1。8g硫黄在O2中完全燃烧生成气态SO2,放出的热量能使500g H2O的温度由18℃升至58℃,则硫黄燃烧热的热化学方程式为___。